Allotropes vs. Isomères

- 3308
- 1026
- Sarah Poirier
Allotropes sont des modifications structurelles différentes d'un élément alors que isomères sont des composés chimiques qui partagent la même formule moléculaire mais ont des formules structurelles différentes.
Certains éléments peuvent exister sous deux ou plusieurs formes différentes. Ces formes sont appelées allotropes dans lequel les atomes de l'élément sont liés ensemble d'une manière différente. Par exemple, dioxygène (o2), ozone (o3), tétraoxygène (o4) et octaoxygène (o8) sont des allotropes d'oxygène. Un autre exemple est le carbone dont les allotropes incluent le graphite et le diamant. En bref, les allotropes contiennent le même élément (les mêmes atomes) qui se lient ensemble de différentes manières pour produire des structures moléculaires différentes.
En revanche, isomères sont des composés (Voir les éléments vs. Composés) qui partagent la même formule moléculaire mais ont des formules structurelles différentes. Les isomères ne partagent pas leurs propriétés chimiques à moins qu'elles appartiennent au même groupe fonctionnel. Par exemple, le propanol a la formule C3H8O (ou c3H7OH) et se produit sous forme de deux isomères: propan-1-ol (alcool n-propyle; je) et le propan-2-ol (alcool isopropylique; Ii). La différence entre les deux isomères réside dans la position de l'atome d'oxygène: elle est attachée à un carbone de fin dans Propan-1-ol, et au carbone central dans Propan-2-ol. Il y a un troisième isomère de C3H8O dont les propriétés sont si différentes que ce n'est pas un alcool (comme le propanol) mais un éther. Appelé méthoxyéthane (méthyl-éthyl-éther; III), cet isomère a un oxygène connecté à deux carbones plutôt qu'à un carbone et à un hydrogène.
Tableau de comparaison
| Allotropes | Isomères | |
|---|---|---|
| Définition | Les allotropes sont des modifications structurelles différentes d'un élément. Par exemple O et O2 | Les isomères sont des composés chimiques qui partagent la même formule moléculaire mais ont des formules structurelles différentes. |
| Exemples | Diamant, graphite, etc. | 2-méthylpropan-1-ol et 2-méthylpropan-2-ol. |
Histoire des allotropes et isomères
L'allotropie et l'isomérisme étaient des concepts proposés par le scientifique suédois Jöns Jakob Berzelius. Il a proposé le concept de allotropie en 1841. Après l'acceptation de l'hypothèse d'Avogadro en 1860, il a été compris que les éléments pouvaient exister sous forme de molécules polyatomiques, et les deux allotropes d'oxygène étaient reconnus comme o2 et o3. Au début du 20e siècle, il a été reconnu que d'autres cas tels que le carbone étaient dus à des différences de structure cristalline.
L'isomérisme a été remarqué pour la première fois en 1827, lorsque Friedrich Woehler a préparé l'acide cyanique et a noté que bien que sa composition élémentaire était identique à l'acide fulminique (préparé par Justus von Liebig l'année précédente), ses propriétés étaient assez différentes. Cette constatation a contesté la compréhension chimique dominante de l'époque, qui a soutenu que les composés chimiques ne pouvaient être différents que lorsqu'ils avaient des compositions élémentaires différentes. Après des découvertes supplémentaires du même genre ont été faites, comme la découverte de Woehler en 1828 que l'urée avait la même composition atomique que le cyanate d'ammonium chimiquement distinct, Jöns Jakob Berzelius a présenté le terme isomérisme pour décrire le phénomène.
Types d'isomères
Différentes classes d'isomères incluent les stéréoisomères, les énantiomères et les isomères géométriques.
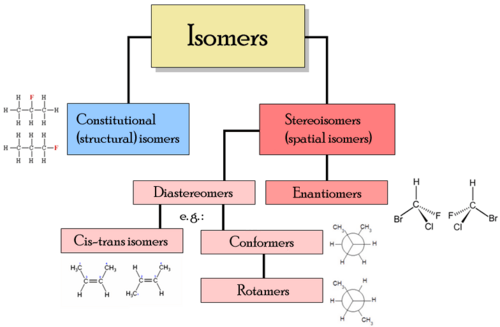 Types d'isomères
Types d'isomères - Isomères structurels - Dans les isomères structurels, les atomes et les groupes fonctionnels sont réunis de différentes manières. Les types d'isomères structurels comprennent:
- Isomérisme de la chaîne - Les chaînes d'hydrocarbures ont des quantités variables de ramification
- positionner l'isoméririsme - traite de la position d'un groupe fonctionnel sur une chaîne
- Isomérisme de groupe fonctionnel - Un groupe fonctionnel est divisé en différents.
- isomères squelettiques - La chaîne de carbone principale est différente entre les deux isomères.
- Tautomères - isomères structurels de la même substance chimique qui interconverse spontanément.
- Stéréoisomères - Dans les stéréoisomères, la structure de liaison est la même, mais le positionnement géométrique des atomes et des groupes fonctionnels dans l'espace est différent. Les types de stéréoisomères comprennent:
- énantiomères - Différents isomères sont des images miroir non superprimables les uns des autres
- diastéréomères - Les isomères ne sont pas des images mirro les unes des autres

