Butane vs. Méthane

- 1358
- 156
- Anaïs Fournier
Butane et méthane sont des hydrocarbures des mêmes composés familiaux chimiques appelés alcanes. Ce sont des composants du gaz naturel et de l'extraction du pétrole.
Tableau de comparaison
Différences - similitudes -| Butane | Méthane | |
|---|---|---|
| Numero CAS | 106-97-8 Y | 74-82-8 Y |
| Se publier | 7843 | 297 |
| Chemspider | 7555 | 291 |
| Souriant | CCCC | C |
| Inchi | 1 / C4H10 / C1-3-4-2 / H3-4H2,1-2H3 | 1 / CH4 / H1H4 |
| Formule moléculaire | C4H10 | Ch4 |
| Masse molaire | 58.12 g mol - 1 | 16.042 g / mol |
| Apparence | Gaz incolore | Gaz incolore |
| Densité | 2.48 kg / m3, gaz (15 ° C, 1 atm) 600 kg / m3, liquide (0 ° C, 1 atm) | 0.717 kg / m3, gaz 415 kg / m3 liquide |
| Point de fusion | −138.4 ° C (135.4 k) | -182.5 ° C, 91 K, -297 ° F |
| Point d'ébullition | −0.5 ° C (272.6 k) | -161.6 ° C, 112 K, -259 ° F |
| solubilité dans l'eau | 6.1 mg / 100 ml (20 ° C) | 35 mg / L (17 ° C) |
| MSD | MSD externe | MSD externe |
| NFPA 704 | 4 1 0 | 4 1 0 |
| point de rupture | -60 ° C | -188 ° C |
| Limites explosives | 1.8 - 8.4% | 5 - 15% |
| Alcanes connexes | Propane; Pentane | Éthane, propane |
| Composés apparentés | Isobutane; Cyclobutane | Méthanol, chlorométhane, acide formique, formaldéhyde, silane |
| Structure et propriétés | n, εr, etc. | n, εr, etc. |
| Données thermodynamiques | Comportement de phase solide, liquide, gaz | Comportement de phase solide, liquide, gaz |
| Données spectrales | UV, IR, RMN, MS | UV, IR, RMN, MS |
| Les usages | Le butane est utilisé dans la réfrigération, les briquets de cigarettes, le chauffage en tant que GPL ou le gaz de pétrole liquéfié. | Le méthane est une source d'énergie utilisée à des fins de chauffage. |
| Effets nuisibles | Le butane peut provoquer une asphyxie et une fibrillation ventriculaire. | Le méthane est un puissant gaz à effet de serre. Il peut former des mélanges explosifs avec de l'air. |
| Sources | Pétrole brut, gaz naturel. | Champs de gaz naturel, production de biogaz, méthane atmosphérique, méthane terrestre supplémentaire. |
Formule chimique et structure moléculaire du méthane vs butane
Le butane est C4Hdix tandis que le méthane a la formule chimique - ch4. Ainsi, il y a quatre atomes d'hydrogène dans une molécule de méthane pendant qu'il y a dix atomes d'hydrogène dans une molécule de butane. La molécule du méthane forme une structure tétraédrique tandis que le butane est une structure linéaire.
 Molécule de méthane - rendu 3D
Molécule de méthane - rendu 3D 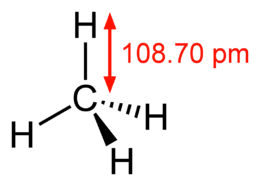 Molécule de méthane - formule structurelle déterminée à l'aide de la spectroscopie micro-ondes
Molécule de méthane - formule structurelle déterminée à l'aide de la spectroscopie micro-ondes  Molécule de butane - rendu tridimensionnel
Molécule de butane - rendu tridimensionnel 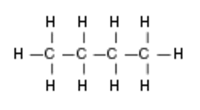 Molécule de butane - formule chimique
Molécule de butane - formule chimique Réactions chimiques du méthane et du butane
Butane réagit avec l'oxygène pour former du dioxyde de carbone et de la vapeur d'eau. Dans des conditions d'oxygène limité, le butane peut former du monoxyde de carbone ou du carbone carbonisé. Il réagit avec le chlore pour donner des chlorobutanes et d'autres dérivés. Méthane subit une combustion pour donner du formaldéhyde, du monoxyde de carbone et enfin du dioxyde de carbone et de la vapeur d'eau. Le processus est connu sous le nom de pyrolyse.
Facilité de manipulation
Le méthane et le butane sont des gaz sans odor à des températures ambiantes. Butane peut être facilement liquéfié, il est donc vendu comme carburant pour le camping et la cuisson. Il est mélangé avec du propane et d'autres hydrocarbures à partir du GPL qui est utilisé commercialement à des fins de chauffage et de cuisson. Méthane est difficile à transporter et est transporté par des pipelines et des transporteurs de GNL.
Contrairement au méthane qui est un gaz tenace en pression et température normales, le butane se transforme en liquide lorsqu'il est comprimé. Cette propriété est attribuée aux faibles liaisons d'atome de carbone central. Dès que ce gaz liquéfié entre en contact avec l'air, il réagit avec la source d'allumage et devient inflammable.
Isomères
Le butane présente un isoméririsme structurel contrairement au méthane et a deux isomères, n-butane et iso-butane. Le méthane ne présente pas d'isomérisme.
Utilisations de méthane vs butane
Le butane est utilisé dans les déodorants, les briquets de cigarettes, les cylindres à gaz de cuisson et de chauffage, le propulseur dans les pulvérisations d'aérosols et les réfrigérants, etc. Le méthane également connu sous le nom de gaz de marais ou de marais est utilisé pour tirer des stations de production électrique, des automobiles électriques, etc.
Sources
Méthane se trouve dans les zones humides et les océans, l'atmosphère, les sources humaines comme le carburant brûlant, l'augmentation du bétail, la fermentation de la matière organique, etc. Butane peut être obtenu sous forme de sous-produit lors de l'extraction du pétrole brut et est une composante du gaz naturel.

