Composé vs. Élément
- 2353
- 726
- Anaïs Fournier
Éléments et composés sont des substances chimiques pures trouvées dans la nature. Le différence entre un élément et un composé Est-ce qu'un élément est une substance composée du même type d'atomes, tandis qu'un composé est composé d'éléments différents dans des proportions définies. Exemples d'éléments Inclure le fer, le cuivre, l'hydrogène et l'oxygène. Exemples de composés Inclure l'eau (H2O) et sel (chlorure de sodium - NaCl).
Les éléments sont répertoriés en fonction de leur numéro atomique sur le tableau périodique. Parmi les 117 éléments connus, 94 sont naturels comme le carbone, l'oxygène, l'hydrogène, etc. 22 sont produits artificiellement après avoir subi des changements radioactifs. La raison en est leur instabilité en raison de laquelle ils subissent une décroissance radioactive sur une période de temps donnant naissance à de nouveaux éléments pendant le processus comme l'uranium, le thorium, le bismuth, etc. Les éléments se combinent dans des rapports fixes et donnent une augmentation de composés stables en raison de liaisons chimiques qui facilitent la formation de composés.
Tableau de comparaison
| Composé | Élément | |
|---|---|---|
| Définition | Un composé contient des atomes de différents éléments combinés chimiquement dans un rapport fixe. | Un élément est une pure substance chimique faite du même type d'atome. |
| Composition | Les composés contiennent différents éléments dans un rapport fixe disposé de manière définie à travers des liaisons chimiques. Ils ne contiennent qu'un seul type de molécule. Les éléments qui composent le composé sont combinés chimiquement. | Les éléments ne contiennent qu'un seul type d'atome. Chaque atome a le même numéro atomique I.e., le même nombre de protons dans leur noyau. |
| Capacité à se décomposer | Un composé peut être séparé en substances plus simples par des méthodes / réactions chimiques. | Les éléments ne peuvent pas être décomposés en substances plus simples par des réactions chimiques. |
| Représentation | Un composé est représenté en utilisant sa formule chimique qui représente les symboles de ses éléments constitutifs et le nombre d'atomes de chaque élément dans une molécule du composé. | Un élément est représenté en utilisant des symboles. |
| Les types | Un nombre énorme, pratiquement illimité, le nombre de composés chimiques peut être créé. Les composés sont classés en composés moléculaires, composés ioniques, composés intermétalliques et complexes. | Il y a environ 117 éléments qui ont été observés. Peut être classé comme métal, non métal ou métalloïde. |
| Exemples | L'eau (H2O), le chlorure de sodium (NaCl), le bicarbonate de sodium (NAHCO3) et l'acide chlorhydrique (HCL) sont des exemples de composés. | L'hydrogène (H), l'oxygène (O), le sodium (Na), le chlore (CL), le carbone (C), le fer (Fe), le cuivre (Cu), l'argent (AG) et l'or (AU) sont des exemples d'éléments. |
Différences de propriétés
Éléments se distinguent par leur nom, symbole, numéro atomique, point de fusion, point d'ébullition, densité et énergies d'ionisation. Dans le tableau périodique, les éléments sont organisés en fonction de leur nombre atomique et ils sont regroupés en fonction de propriétés chimiques similaires et sont représentés par leurs symboles.
- Numéro atomique - Le numéro atomique est indiqué par la lettre Z et est le nombre de protons présents dans le noyau de l'atome de l'élément. Pour e.g. Le carbone a 6 protons dans son noyau et pour le carbone, z = 6. Le nombre de protons indique également une charge électrique ou un nombre d'électrons présents dans le noyau qui détermine les propriétés chimiques de l'élément.
- Masse atomique - la lettre UN indique la masse atomique de l'élément qui est le nombre total de protons et de neutrons dans le noyau d'un atome de l'élément. Les isotopes des mêmes éléments diffèrent dans leurs masses atomiques.
- Isotopes - Les isotopes d'un élément ont le même nombre de protons dans leur noyau mais diffèrent dans le nombre de neutrons. Les éléments naturels ont plus d'un isotope stable. Ainsi, les isotopes ont des propriétés chimiques similaires (en raison du même nombre de protons) mais différentes propriétés nucléaires (en raison du nombre différent de neutrons). Pour e.g. Le carbone a trois isotopes, carbone - 12, carbone -13 et carbone - 14.
- Allotropes - Les atomes d'un élément peuvent former des liaisons entre eux de plus d'une manière conduisant à la différence dans leurs propriétés chimiques. Pour e.g. Le carbone se lie dans un tétraèdre pour former du diamant et des couches d'hexagones de formes de carbone graphite.
Composés sont composés d'éléments différents dans une proportion fixe. Par exemple, 1 atome de sodium (NA) se combine avec 1 atome de chlore (CL) pour former une molécule de composé de chlorure de sodium (NaCl). Les éléments d'un composé ne conservent pas toujours leurs propriétés d'origine et ne peuvent pas être séparées par des moyens physiques. La combinaison des éléments est facilitée par leur valence. La valence est définie comme le nombre d'atomes d'hydrogène requis qui peuvent se combiner avec un atome de l'élément formant le composé. La plupart des composés peuvent exister sous forme de solides (températures suffisamment basses) et peuvent être décomposées par l'application de la chaleur. Parfois, les éléments étrangers sont piégés à l'intérieur de la structure cristalline des composés leur donnant une structure non homogène. Les composés sont représentés par leur formule chimique qui suit le système de colline dans lequel les atomes de carbone sont répertoriés en premier, suivis des atomes d'hydrogène, après quoi les éléments sont répertoriés dans l'ordre alphabétique.
Visualiser les différences
Cette image montre les différences entre les éléments et les composés au niveau atomique. Les éléments n'ont qu'un seul type d'atomes; Les composés en ont plus de 1. Les éléments et les composés sont les deux substances; Ils diffèrent des mélanges où différentes substances se mélangent mais pas via des liaisons atomiques.
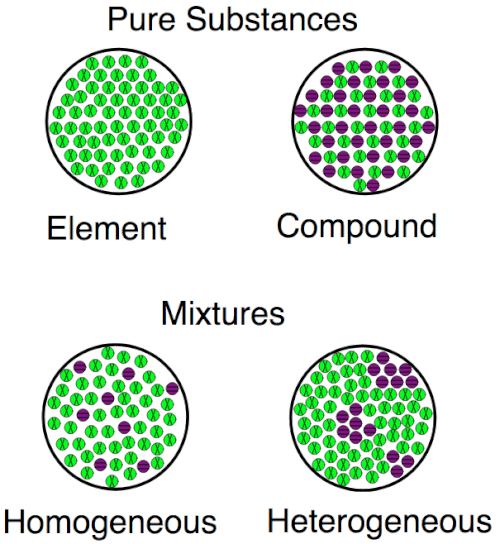 Une visualisation des différences entre les éléments, les composés et les mélanges, à la fois homogène et hétérogène.
Une visualisation des différences entre les éléments, les composés et les mélanges, à la fois homogène et hétérogène. Histoire des éléments et des composés
Éléments ont été initialement utilisés comme référence à tout état de matière comme le liquide, le gaz, l'air, le solide, etc. Les traditions indiennes, japonaises et grecques se réfèrent à cinq éléments, à savoir l'air, l'eau, la terre, le feu et l'éther. Aristote a conceptualisé un nouvel cinquième élément appelé «quintessence» - qui a apparemment formé le ciel. Alors que la recherche se poursuivait, de nombreux scientifiques éminents ont ouvert la compréhension et la description actuelles des éléments. Parmi eux, les travaux de Robert Boyle, Antoine Lavoisier, Dmitri Mendeleev sont particulièrement notables. Lavoisier a été le premier à établir une liste d'éléments chimiques et Mendeleev a été le premier à organiser des éléments selon leur numéro atomique dans le tableau périodique. La définition la plus récente d'un élément est attribuée par les études menées par Henry Moseley qui indique que le nombre atomique d'un atome est exprimé physiquement par sa charge nucléaire.
Avant les années 1800, l'utilisation du terme composé pourrait aussi signifier un mélange. C'est au 19e siècle que le sens d'un composé pouvait être distingué d'un mélange. Des alchimistes comme Joseph Louis Proust, Dalton et Berthollet et leurs études sur divers composés ont donné à la chimie moderne la définition actuelle du composé. Les travaux de Proust ont démontré au monde de la chimie que des composés ont été faits constants en composition d'éléments respectifs.
Numero CAS
Chaque substance chimique est identifiée par son identifiant numérique unique - le numéro CAS (Service des résumés chimiques). Par conséquent, chaque composé chimique et élément a un numéro CAS. Cela rend les recherches de base de données d'éléments et de composés plus pratiques.

