Liaisons covalentes vs. Des liaisons ioniques
- 2799
- 706
- Adrien Jean
Il existe deux types de liaisons atomiques - des liaisons ioniques et des liaisons covalentes. Ils diffèrent dans leur structure et leurs propriétés. Des liaisons covalentes se composent de paires d'électrons partagées par deux atomes et de lier les atomes dans une orientation fixe. Des énergies relativement élevées sont nécessaires pour les casser (50 - 200 kcal / mol). La question de savoir si deux atomes peuvent former une liaison covalente dépend de leur électronégativité I.e. la puissance d'un atome dans une molécule pour attirer des électrons vers lui-même. Si deux atomes diffèrent considérablement dans leur électronégativité - comme le font le sodium et le chlorure - alors l'un des atomes perdra son électron à l'autre atome. Il en résulte un ion chargé positivement (cation) et un ion chargé négativement (anion). Le lien entre ces deux ions est appelé un liaison ionique.
Tableau de comparaison
| Des liaisons covalentes | Des liaisons ioniques | |
|---|---|---|
| Qu'est-ce que c'est? | La liaison covalente est une forme de liaison chimique entre deux atomes non métalliques qui se caractérisent par le partage de paires d'électrons entre les atomes et d'autres liaisons covalentes. | La liaison ionique, également connue sous le nom de liaison électrovalente, est un type de liaison formé à partir de l'attraction électrostatique entre les ions chargés de facturation opposée dans un composé chimique. Ces types de liaisons se produisent principalement entre un atome métallique et un atome non métallique. |
| Formation | Une liaison covalente se forme entre deux non-métaux qui ont des électronégativités similaires. Aucun des deux atomes n'est "assez fort" pour attirer les électrons de l'autre. Pour la stabilisation, ils partagent leurs électrons de l'orbite moléculaire externe avec d'autres. | Une liaison ionique se forme entre un métal et un non-métal. Les non-métaux (-ve ion) sont "plus forts" que le métal (+ ve ion) et peuvent obtenir des électrons très facilement à partir du métal. Ces deux ions opposés s'attirent et forment le lien ionique. |
| Se produit entre | Deux non-métaux | Un métal et un non-métal |
| Électrons | Les électrons sont partagés dans des liaisons covalentes. | Dans les obligations ioniques, les électrons sont transférés d'un atome à un autre, résultant en deux ions chargés - un chargé positivement et un chargé négativement. Les deux ions sont attirés l'un vers l'autre et forment un lien ionique. |
| Exemples | Méthane (CH4), acide hydro chlorique (HCl) | Chlorure de sodium (NaCl), acide sulfurique (H2SO4) |
| Point de fusion | Faible | Haut |
| Se dissoudre dans l'eau? | Varie | Oui |
| Polarité | Faible | Haut |
| Forme | Forme définitive | Aucune forme définie |
| Point d'ébullition | Faible | Haut |
| État à température ambiante | Liquide ou gazeux | Solide |
| Cohérence | Doux | Fragile |
Sur les liaisons covalentes et ioniques
La liaison covalente est formée lorsque deux atomes sont capables de partager des électrons alors que la liaison ionique se forme lorsque le "partage" est si inégal qu'un électron de l'atome A est complètement perdu contre l'atome B, entraînant une paire d'ions.
Chaque atome se compose de protons, de neutrons et d'électrons. Au centre de l'atome, les neutrons et les protons restent ensemble. Mais les électrons tournent en orbite autour du centre. Chacune de ces orbites moléculaires peut avoir un certain nombre d'électrons pour former un atome stable. Mais en dehors du gaz inerte, cette configuration n'est pas présente avec la plupart des atomes. Donc, pour stabiliser l'atome, chaque atome partage la moitié de ses électrons.
La liaison covalente est une forme de liaison chimique entre deux atomes non métalliques qui se caractérisent par le partage de paires d'électrons entre les atomes et d'autres liaisons covalentes. La liaison ionique, également connue sous le nom de liaison électrovalente, est un type de liais. Ce type de liaisons se produit principalement entre un atome métallique et un atome non métallique.
Formation et exemples
Les obligations covalentes sont formées à la suite du partage d'une ou plusieurs paires d'électrons de liaison. Les électro négativités (capacité d'attraction d'électrons) des deux atomes liés sont soit égaux, soit la différence n'est pas supérieure à 1.7. Tant que la différence d'électro-négativité n'est pas supérieure à 1.7, les atomes ne peuvent partager que les électrons de liaison.
 Un modèle des liaisons covalentes doubles et simples de carbone dans un anneau de benzène.
Un modèle des liaisons covalentes doubles et simples de carbone dans un anneau de benzène. Par exemple, considérons une molécule de méthane I.e.Ch4. Le carbone a 6 électrons et sa configuration électronique est 1S22S22P2, I.e. Il a 4 électrons sur son orbite extérieure. Selon la règle de l'octate (il indique que les atomes ont tendance à gagner, perdre ou partager des électrons afin que chaque atome ait un niveau d'énergie le plus extérieur qui est généralement 8 électrons.), pour être dans un état stable, il a besoin de 4 électrons supplémentaires. Il forme donc une liaison covalente avec de l'hydrogène (1S1), et en partageant des électrons avec de l'hydrogène, il forme du méthane ou du ch4.
Si la différence d'électro-négativité est supérieure à 1.7 Ensuite, l'atome électronégatif supérieur a une capacité d'attraction d'électrons qui est suffisamment grande pour forcer le transfert d'électrons de l'atome électronégatif moindre. Cela provoque la formation de liaisons ioniques.
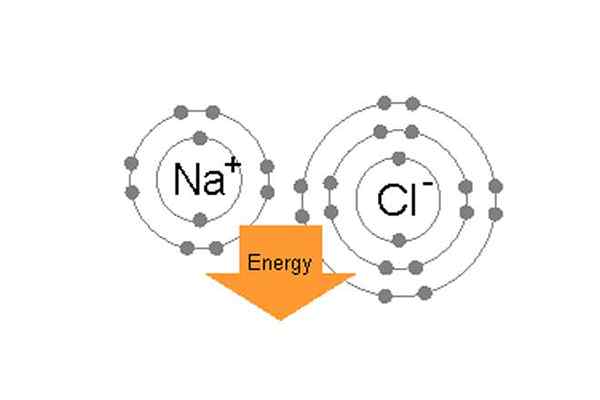
 Liaison de sodium et de chlore ioniquement pour former du chlorure de sodium.
Liaison de sodium et de chlore ioniquement pour former du chlorure de sodium. Par exemple, dans le sel de table commun (NaCl), les atomes individuels sont du sodium et du chlore. Le chlore a sept électrons de valence sur son orbite extérieure mais pour être dans un état stable, il a besoin de huit électrons en orbite extérieure. D'un autre côté, le sodium a un électron de valence et il a également besoin de huit électrons. Puisque le chlore a une élection électrique élevée, 3.16 par rapport au 0 sodium.9, (donc la différence entre leur électro-négativité est supérieure à 1.7) Le chlore peut facilement attirer un électron de valence de sodium. De cette manière, ils forment une liaison ionique et partagent les électrons de l'autre et les deux auront 8 électrons dans leur coquille extérieure.
Caractéristiques des liaisons
Les liaisons covalentes ont une forme définitive et prévisible et ont de faibles points de fusion et d'ébullition. Ils peuvent être facilement divisés dans sa structure principale car les atomes sont à proximité pour partager les électrons. Ce sont principalement des gaz et même une légère charge négative ou positive aux extrémités opposées d'une liaison covalente leur donne une polarité moléculaire.
Les liaisons ioniques forment normalement des composés cristallins et ont des points de fusion plus élevés et des points d'ébullition par rapport aux composés covalents. Ceux-ci conduisent l'électricité à l'état fondu ou en solution et ce sont des liaisons extrêmement polaires. La plupart d'entre eux sont solubles dans l'eau mais insolubles dans des solvants non polaires. Ils nécessitent beaucoup plus d'énergie que la liaison covalente pour rompre la liaison entre eux.
La raison de la différence dans les points de fusion et d'ébullition pour les liaisons ioniques et covalentes est que la quantité d'énergie nécessaire pour perturber les forces intermoléculaires entre les molécules formées via des liaisons covalentes est bien inférieure à l'énergie nécessaire pour briser les liaisons ioniques dans un composé ionique cristallin.

