Différence entre adiabatique, isotherme et isobare
- 3280
- 536
- Sarah Poirier

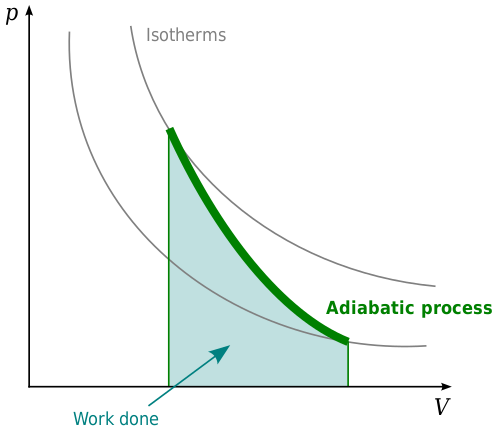
Qu'est-ce que l'adiabatique?
Un système ou un processus adiabatique est celui dans lequel il n'y a pas de changement net d'énergie thermique. Les processus adiabatiques sont liés à la première loi de la thermodynamique. Cette loi stipule que lorsque l'énergie thermique est placée dans un système, elle modifiera l'énergie interne du système ou fonctionnera. Ceci est lié à la loi de la conservation de l'énergie qui indique que la matière et l'énergie ne peuvent être créées ou détruites. Dans le contexte de la thermodynamique, l'énergie thermique dans un système doit faire quelque chose. Il modifiera l'énergie interne du système, travaillera ou une combinaison des deux. Il ne peut pas simplement disparaître.
Dans un système adiabatique, la pression, le volume et la température changent de telle manière que l'énergie thermique reste constante. Les processus adiabatiques sont le plus clairement observés dans les gaz. Le chauffage adiabatique dans un gaz entraînera une augmentation de la température à mesure que la pression sur le gaz augmente. Si la pression sur le gaz diminue, cela entraînera une baisse de la température, entraînant un refroidissement adiabatique. Avec le chauffage adiabatique, le gaz sera comprimé et le travail sera donc effectué sur le gaz par l'environnement. Si le refroidissement adiabatique se produit, cela entraînera l'expansion du gaz et le gaz fonctionnera sur l'environnement.
Un exemple où les processus adiabatiques sont importants est dans le contexte d'un piston, comme un piston dans un moteur diesel. À mesure que la pression du piston augmente, le gaz se contractera. Avec décompression, le gaz se développera à nouveau, déplaçant le piston. Ceci est contrôlé par des processus adiabatiques.
Les processus adiabatiques sont importants en météorologie. Si une parcelle d'air augmente, la pression sur le paquet d'air diminuera et cela entraînera une diminution de la température de l'air en raison du refroidissement adiabatique. D'un autre côté, si une masse aéronautique est poussée contre le sol, cela entraînera une augmentation de la pression sur l'aérmasse, réchauffant l'avion. Étant donné que la pression de l'air diminue avec l'altitude, la température diminuera avec la hauteur de l'atmosphère. La vitesse à laquelle la température diminue avec l'augmentation de l'altitude est connue sous le nom de taux de laps Adiabatique.
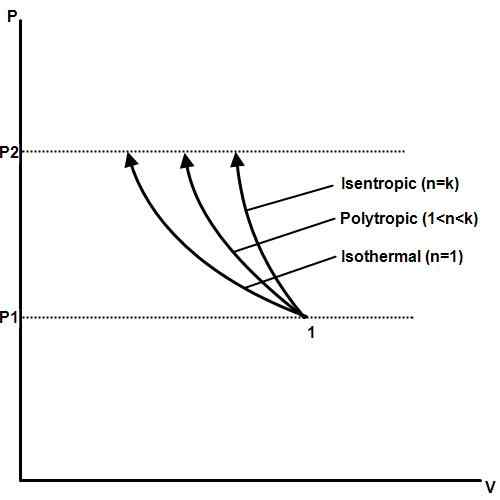
Qu'est-ce que l'isotherme?
Un processus isotherme est celui où la température reste constante même si la pression et le volume changent. Dans la thermodynamique, la pression, la température et le volume sont liés par la loi sur le gaz de Boyle. Si l'un est maintenu constant, les autres changent de proportion les uns avec les autres. Si la température d'un gaz est maintenue constante, la pression et le volume du gaz seront inversement proportionnels.
Un exemple de processus isotherme est un changement de phase. Lorsqu'une substance, comme l'eau, atteint son point de fusion ou son point d'ébullition, la pression et la température resteront constantes comme la phase, le volume et le changement d'énergie thermique.
Les processus isothermes forment la base des moteurs thermiques qui sont utilisés dans les centrales électriques, les voitures, les avions, les roquettes et autres machines qui sont importantes pour la civilisation moderne. Les processus isothermes sont également importants en biologie, géologie, science de l'espace, sciences planétaires et de nombreux autres domaines.
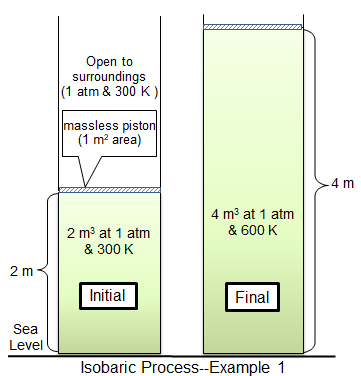
Qu'est-ce que l'isobarique?
Dans un processus isobare, la pression dans un système reste constante. Dans des conditions isobares, le volume et la température sont directement liés. Si la température augmente, le volume le doit aussi. Cela peut être illustré en plaçant un ballon dans un congélateur. La pression à l'intérieur du ballon et de l'extérieur restera constante, mais le ballon commencera à rétrécir en volume en refroidissant.
Un autre exemple est un piston pondéré qui est déplacé par du gaz chauffé dans un cylindre. Lorsque le gaz est chauffé, la température du gaz augmente et que le gaz se dilate, poussant le piston. Si le piston était fixe et ne pouvait pas bouger, la pression dans le gaz augmenterait au lieu de l'expansion du gaz et le système ne serait pas isobare.
Les processus isobares sont importants dans la construction de moteurs thermiques, car certains moteurs thermiques s'appuient sur des processus isobares pour convertir l'énergie thermique en énergie mécanique.
Similitudes entre adiabatique vs. isotherme vs. isobare
Les processus adiabatiques, isothermes et isobares sont tous liés à la pression, à la température et au volume. Ils sont également tous les plus bien illustrés avec des gaz. Les trois types de processus sont également les plus pertinents dans les atmosphères planétaires.
Différences entre adiabatique vs. isotherme vs. isobare
Bien que ces processus aient des similitudes, elles ont également des différences importantes. Ceux-ci incluent ce qui suit.
- La température d'un gaz diminuera à mesure que le gaz se développe dans un système adiabatique, tandis que la température restera constante à mesure que le gaz se développe dans un système isotherme et augmente à mesure que le gaz se développe dans un système isobare.
- Dans un système adiabatique ou isotherme, le volume d'un gaz est inversement proportionnel à la température, alors qu'il est directement proportionnel à la température dans un système isobare.
- La pression d'un gaz est inversement proportionnelle au volume dans un système isotherme, alors qu'il ne change pas dans un système isobare, et la pression sur un gaz est inversement proportionnelle au volume dans un système adiabatique.
- La chaleur ne change pas dans un système adiabatique, alors qu'il change dans un système isotherme ou isobare.
Adiabatique vs. isotherme vs. isobare

Résumé
Dans un système adiabatique, il n'y a pas de changement net de chaleur. Lorsqu'un gaz se développe, la température baisse, conduisant à un refroidissement adiabatique. Si un gaz est comprimé, la température augmentera, conduisant à un chauffage adiabatique. Les processus adiabatiques sont importants dans les sciences atmosphériques. Dans un processus isotherme, la température est constante et la pression et le volume sont inversement liés les uns aux autres. Un exemple de processus isotherme est un changement de phase. Pendant le changement de phase, la température d'une substance ne changera pas même si sa chaleur et son volume changent. Dans un système isobare, la pression reste constante et le volume augmentera ou diminuera avec la température. Si un volume de gaz est placé dans un congélateur, par exemple, le volume de gaz diminuera car la pression est constante tandis que sa température baisse.
- « Différence entre l'antithèse et l'oxymore
- Différence entre la conformité et la pression des pairs »

