Différence entre l'affinité et l'avidité
- 3713
- 86
- Juliette Paul
Alors que la thermodynamique théorique des interactions antigène-anticorps est bien connue, leur utilisation pratique dans la détection ou la détermination des auto-anticorps est rare. Pour les anticorps fonctionnels, la détermination de l'affinité optimale permet la réalisation de l'avantage thérapeutique maximal. L'affinité des anticorps est étudiée depuis près d'un demi-siècle et depuis la création de la chromatographie sur l'affinité il y a trois décennies, elle est devenue un outil puissant. Affinité décrit l'interaction dans un site de liaison individuel. La connaissance de l'affinité ainsi que des propriétés de construction et d'antigène est essentielle pour évaluer le lien entre l'affinité et la puissance d'un anticorps fonctionnel. Cependant, en plus de l'affinité, il existe un autre concept de liaison appelé Avidité, qui est la force de liaison globale de l'interaction entre un antigène multivalent et un anticorps multivalent. Malgré les différences claires entre les deux, l'affinité des termes et l'avidité sont souvent utilisées sans discrimination. Jetons un coup d'œil les deux.

Qu'est-ce que l'affinité?
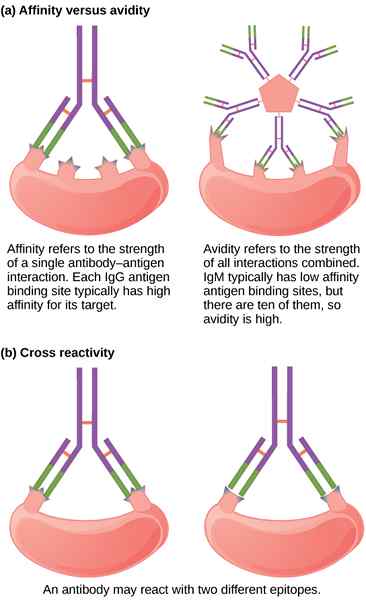
L'affinité est la force de liaison du paratope d'une molécule d'anticorps avec son épitope correspondant sur la molécule d'antigène. Il décrit l'interaction dans un site de liaison individuel. La connaissance de l'affinité ainsi que des propriétés de construction et d'antigène est essentielle pour évaluer le lien entre l'affinité et la puissance d'un anticorps fonctionnel. Il est basé sur les mêmes principes thermodynamiques qui régissent toute interaction biomoléculaire réversible, la même force de liaison qui permette à votre système immunitaire de combattre les infections. Et la force fait référence à la force d'un lien spécifique entre un anticorps et son antigène. Une évaluation précise et précise de l'affinité pour une interaction antigène-anticorps est une mesure importante pour établir des limites d'affinité et le plafond de puissance pour un anticorps thérapeutique. En termes thermodynamiques, l'affinité est exprimée comme la sommation de toutes les forces d'attraction entraînant une résistance accrue de liaison et des forces répulsives entraînant une diminution de la résistance de liaison.
Qu'est-ce que l'avidité?
L'avidité est encore un autre concept contraignant qui est souvent confondu avec l'affinité; En fait, les deux termes se réfèrent au concept de force de liaison, sauf que l'avidité fait référence à la force totale de la capacité de liaison à l'antigène du mélange d'anticorps polyclonaux. L'avidité arrive à l'image lorsqu'un antigène multivalent se lie à un anticorps bivalent en solution ou lorsqu'un anticorps se lie à deux molécules d'antigène monovalent sur une surface. Contrairement à l'affinité, Avidité décrit la liaison multivalente entre plusieurs sites de liaison du ligand et de la ligature, respectivement. En termes simples, l'avidité est la force de liaison entre un anticorps multivalent et un antigène multivalent. L'avidité ne peut pas être décrite par des termes thermodynamiques et est obtenue par des mesures cinétiques. L'avidité de l'anticorps dépend des affinités des sites de liaison des anticorps individuels, mais est supérieur à l'affinité de liaison car toutes les interactions anticorps-antigène doivent être cassées simultanément pour l'anticorps pour se dissocier complètement.
Différence entre l'affinité et l'avidité
Définition de l'affinité et de l'avidité
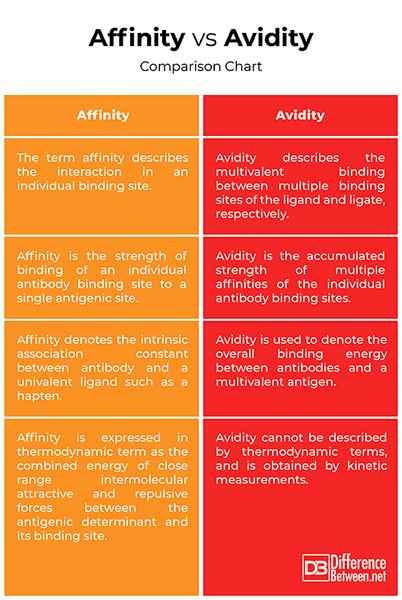
Les termes affinité et avidité sont parfois utilisés de manière inappropriée comme synonymes. En fait, les deux termes se réfèrent au concept de force contraignante. L'affinité est définie en termes thermodynamiques comme la mesure du degré d'association entre l'anticorps et l'antigène, tandis que la résistance globale liant un anticorps multivalent avec un antigène multivalent est appelée avidité, ou autrement connue sous le nom de «affinité fonctionnelle.«L'affinité est la force de la liaison d'un anticorps combinant le site à un épitope d'antigène correspondant, tandis que l'avidité est la force totale de la capacité de liaison à l'antigène du mélange d'anticorps polyclonaux. Avidité est également appelée affinité fonctionnelle.
Occurrence
Le terme affinité dénote la constante d'association intrinsèque entre l'anticorps et un ligand univalent tel qu'un hapten, tandis que le terme avidité est utilisé pour désigner l'énergie globale de liaison entre les anticorps et un antigène multivalent. La constante d'association est une mesure de l'affinité de l'anticorps pour l'épitope. L'avidité ne peut pas être décrite par des termes thermodynamiques et est obtenue par des mesures cinétiques. En termes thermodynamiques, l'affinité est exprimée comme la sommation de l'énergie des forces attrayantes et répulsives intermoléculaires à courte portée entre le déterminant antigénique et son site de liaison.
Signification biologique
L'affinité des anticorps peut jouer un rôle essentiel dans la détermination des activités biologiques des anticorps. Ainsi, il est nécessaire de pouvoir caractériser une réponse d'anticorps en termes d'affinité ainsi que de magnitude, et aussi de comprendre comment l'affinité des anticorps peut affecter un test particulier. Le terme avidité est parfois utilisé synonyme avec l'affinité, mais le plus souvent, il est utilisé pour décrire la capacité des anticorps à former des complexes stables avec l'antigène. L'avidité est la force accumulée de plusieurs affinités des sites de liaison des anticorps individuels.
Affinité vs. Avidité: tableau de comparaison
Résumé de l'affinité vs. Avidité
Malgré leurs différences, les termes affinité et avidité sont souvent utilisés sans discrimination. L'affinité est la force de liaison du paratope d'une molécule d'anticorps avec son épitope correspondant sur la molécule d'antigène et ne peut être déterminé que par un seul fragment Fab monovalent. C'est la sommation de toutes les forces d'attraction entraînant une résistance accrue de liaison et des forces répulsives entraînant une diminution de la résistance de liaison. L'avidité, en revanche, est la force de liaison entre un anticorps multivalent et un antigène multivalent, et est également appelé affinité fonctionnelle. L'énergie de liaison mesurée entre les anticorps et leurs antigènes correspondants reflète l'avidité des anticorps. Contrairement à l'affinité, l'avidité ne peut pas être décrite par des termes thermodynamiques et est obtenue par des mesures cinétiques.
- « Différence entre l'orteil en alliage et l'orteil en acier
- Différence entre l'alliage et la batte composite »

