Différence entre amine et amide
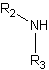
- 995
- 14
- Théo Roy
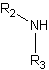 Amine vs. Amide
Amine vs. Amide
Si jamais vous avez accordé une attention particulière à votre professeur de chimie, vous avez peut-être entendu parler des conditions, des amides et des amines. En raison de leur similitude de cisaillement dans l'orthographe, juste une lettre différente de l'autre, les deux termes ont été soumis à beaucoup de confusion. Voici les différences entre les deux termes pour vous aider à clarifier les choses.
Comme mentionné, Amide est un terme que vous entendez souvent dans vos conférences de chimie. Il s'agit essentiellement d'un composé, de nature organique, dont le groupe est lié comme R-C = O, et connecté à un atome d'azote (N). Lorsque vous déprottez NH3, communément appelé ammoniac, vous obtenez également un amide. La déprotonation de l'ammoniac entraîne l'élimination d'un ion hydrogène (h), la NH2 chimique résultante étant lié à un groupe acyl, qui est la liaison R-C = O mentionnée ci-dessus.
Les amides peuvent également être dérivés d'acides, tels que la carboxylique, où le groupe hydroxyle de l'acide a été échangé avec de l'ammoniac. Un autre exemple peut être montré dans l'acide acétique, où le produit résultant est de l'acétamide. La réaction et la séparation des ions ont transformé l'acide en amide. Par conséquent, en nommant ces composés, vous allez juste ajouter Amide comme un suffixe à l'acide parent. L'actique plus amide vous donne de l'acétamide; Sans oublier, vous devez déposer certaines lettres de l'acide parent pour le rendre plus formel. La propriété chimique des amides est également la clé de sa caractéristique. C'est en fait une base faible.
De l'autre côté de la médaille, les amines sont toujours des composés organiques. Comme les amides, ils peuvent également provenir de l'ammoniac, mais sont liés à un alkyle ou à un groupe aryle. Ceci est différent des amides, où la liaison de connexion doit être un acyle. De même, la liaison alkyle et aryle est le reste de l'ammoniac, après qu'un ion hydrogène a été éliminé chimiquement. Des exemples d'amines sont les acides aminés (les éléments constitutifs des protéines) et l'aniline.
En dénovant les amines, vous pouvez réellement placer le préfixe «amino» au début du produit chimique ou du composé, ou du suffixe «amine» après le nom du terme parent. Dont des exemples sont la diamine et le 2-aminopentane. De plus, les amines sont les mêmes que les amides en termes de leurs propriétés chimiques. Les deux composés sont en fait des bases faibles.
Bien que les amides et les amines soient tous deux des composés organiques de base faibles, ils diffèrent toujours dans les aspects suivants:
1. Les amides sont la fusion d'un groupe acyle et le reste de la déprotonation de NH3, tandis que les amines sont la fusion d'un groupe alkyle ou aryle au même produit chimique.
2. Les amides sont nommés en ajoutant le suffixe «amide» après le terme parent, tandis que les amines sont nommées soit en ajoutant le préfixe `` amino '', soit le suffixe `` amine '', avant et après le terme parent, dans l'ordre respectif.
- « Différence entre les tondeuses pour chiens et les tondeuses humaines
- Différence entre SATA et ESATA »

