Différence entre l'énergie des liaisons et l'enthalpie d'énergie de dissociation des liaisons
- 2371
- 708
- Mathilde Roux
Énergie de liaison vs. Énergie de dissociation des liaisons (enthalpie)
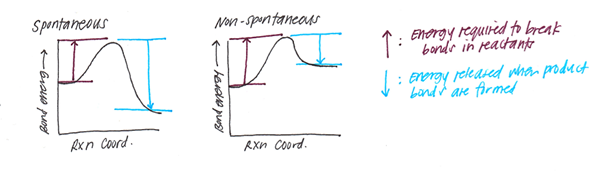
L'énergie de liaison est la valeur moyenne des énergies de dissociation des liaisons en phase gazeuse (généralement à une température de 298 K) existant entre les mêmes types d'atomes. Cependant, l'énergie des liaisons et l'énergie de dissociation des liaisons ne sont pas les mêmes. L'énergie de dissociation des liaisons est le changement d'enthalpie standard lorsqu'une liaison covalente (également appelée liaison moléculaire, est une liaison chimique entre deux atomes non métal pièces) pour donner des fragments; qui sont généralement des espèces radicales. Par conséquent, la principale différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons est que l'énergie de liaison est une valeur moyenne tandis que l'énergie de dissociation des liaisons est une valeur particulière pour une liaison particulière.
Qu'est-ce que l'énergie des liaisons et l'énergie de dissociation des liaisons (enthalpie)?
Énergie de liaison
L'énergie des liaisons fait référence à l'énergie nécessaire pour décomposer toutes les liaisons qui existent entre le même 2 type d'espèces chimiques dans un composé.
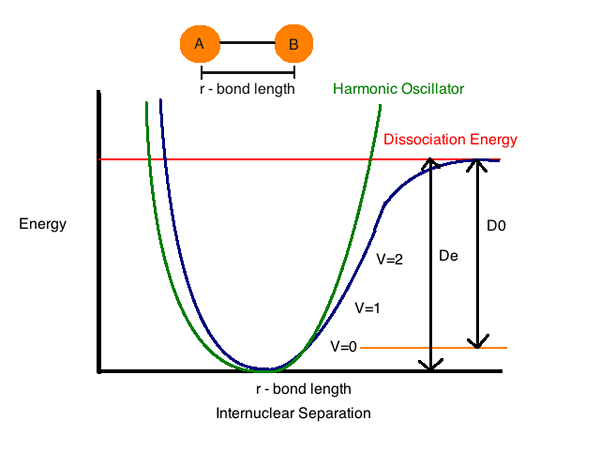
Une parcelle de l'énergie potentielle d'un système à 2 atomes et la distance entre les espèces chimiques montre la distance à laquelle l'énergie est trop moins. Cette distance révélée est la longueur de liaison entre les atomes.
Plus l'énergie de liaison (e) est élevée liée à une paire d'espèces chimiques spécifiques, plus la liaison est forte, et moins la distance entre les 2 atomes.
Énergie de dissociation des liaisons
L'énergie de dissociation des liaisons (enthalpie) (h) est la quantité d'énergie requise pour décomposer une liaison particulière dans l'homolyse. Nous pouvons le définir comme le changement d'enthalpie qui se déroule lorsqu'un lien subit un clivage par homolyse. L'énergie de dissociation des liaisons est spécifique à une seule liaison.
L'enthalpie des liaisons (propriété thermodynamique d'un système) ou l'énergie de dissociation des liaisons, est appelée changement d'enthalpie standard lorsqu'une liaison est clivée (séparée ou divisée) par des homolyses (décomposer en petits morceaux) avec des réactifs et des produits de la réaction d'homolyse au niveau de 0 k (zéro absolu).
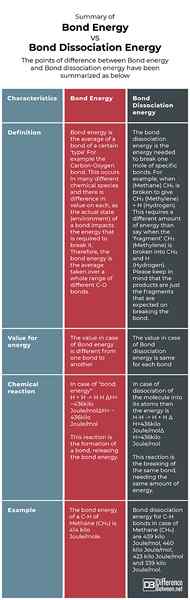
Différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons (enthalpie)
Description
Énergie de liaison
L'énergie des liaisons est également appelée enthalpie des liaisons et elle est définie comme la mesure de la résistance aux liaisons dans une liaison chimique. L'énergie des obligations est une valeur moyenne
Énergie de dissociation des liaisons
L'énergie de dissociation des liaisons est définie comme le changement d'enthalpie standard qui est nécessaire pour rompre une liaison chimique
Produit
Énergie de liaison
Bond Energy offre l'énergie nécessaire pour former les atomes qui sont le matériau de départ pour la formation de liaisons.
Énergie de dissociation des liaisons
L'énergie de dissociation des liaisons a fourni l'énergie nécessaire pour former des radicaux libres des atomes qui ont créé cette liaison particulière.
Exemple
Énergie de liaison
En chimie, l'énergie des liaisons (E) ou l'enthalpie des liaisons (H) est la mesure de la résistance aux liaisons dans une liaison chimique.… Par exemple, l'énergie de liaison (C-H)-carbone-hydrogène dans le méthane (CH4) est le changement d'enthalpie impliqué dans la rupture d'une molécule de CH4 en un atome de carbone (c) et quatre radicaux hydrogène (h), divisé par quatre.
Énergie de dissociation des liaisons
Par exemple, dans la molécule de méthane, les énergies de dissociation des liaisons pour les liaisons C-H sont de 439 kJ / mol, 460 kJ / mol, 423 kJ / mol et 339 kJ / mol. Cependant, l'énergie de liaison du C-H du méthane est de 414 kJ / mol, ce qui est la moyenne des quatre valeurs. De plus, pour une molécule, l'énergie de dissociation des liaisons ne peut pas nécessairement être égale à l'énergie de la liaison (comme pour l'exemple de méthane pré-donné). Pour une molécule diatomique, l'énergie de liaison et l'énergie de dissociation des liaisons sont les mêmes.
Symbole
Énergie de liaison
Il est indiqué par e
Énergie de dissociation des liaisons
Il est indiqué par h
Formation d'obligations
Énergie de liaison
Il donne l'énergie nécessaire pour former les atomes qui étaient le matériau de départ pour la formation de liaisons
Énergie de dissociation des liaisons
Il donne l'énergie nécessaire pour créer des radicaux libres à partir des atomes qui ont créé cette liaison particulière
Résumé de l'énergie des obligations vs. Énergie de dissociation des liaisons
Les points de différence entre l'énergie des liaisons et l'énergie de dissociation des liaisons ont été résumés comme ci-dessous:
- « Différence entre la compétence en matière et la juridiction personnelle
- Différence entre le changement climatique et l'épuisement de l'ozone »

