Différence entre cis et trans

- 2325
- 643
- Elisa Petit
L'isomérisme CIS-Trans consiste en possibilité de placer des groupes de substituants sur un ou sur différents côtés d'un plan à double liaison ou d'un cycle non aromatique. Les isomères CIS-Trans appartiennent aux diastéréomères car ils ne sont pas des réflexions miroir les unes des autres. Les IC et les isomères trans se trouvent à la fois parmi les composés organiques et inorganiques.
La nomenclature CIS-Trans décrit la position relative des substituts et ne fournit pas de description stéréochimique, comme la nomenclature E, applicable uniquement aux alcènes.
L'existence distincte de cis et d'isomères trans n'est possible qu'en raison de la barrière énergétique élevée de la rotation autour de la double liaison.

Qu'est-ce que CIS?
Le préfixe «cis» est dérivé du latin. Cela signifie «du même côté». Dans l'isomère cis, les groupes de substituants sont placés d'un côté d'un plan à double liaison ou d'un cycle non aromatique.
Les IC et les isomères trans diffèrent dans leurs propriétés physiques, en raison de l'inégalité du moment dipolaire global et de la forme des molécules.
Le point d'ébullition relatif est déterminé par la polarité. Il provoque une augmentation des forces intermoléculaires, ce qui entraîne une augmentation du point d'ébullition. Les isomères cis, qui sont plus polaires que les isomères trans, ont un point d'ébullition plus élevé. La différence peut être petite, comme par exemple dans les alcènes avec une chaîne droite. Une plus grande différence est observée dans des substances avec des liaisons polaires. Un exemple pour une telle substance est le 1,2-dichloroéthène. Le point d'ébullition de son isomère cis est de 60.3 ° C, et de son isomère trans - avec 12.8 ° C inférieur. La raison de la différence est que dans l'isomère cis, les deux moments dipolaires des liaisons polaires de C-Cl couple et produisent un dipôle moléculaire global. Par conséquent se produisent les forces dipolaires intermoléculaires, qui soulèvent le point d'ébullition.
La symétrie permet un meilleur emballage des substances solides. À la suite de la symétrie différente des molécules, les isomères cis et trans diffèrent dans leurs points de fusion. Les isomères cis, qui sont moins symétriques, ont un point de fusion plus bas, par rapport aux isomères trans.
Une autre caractéristique des isomères CIS est qu'ils ont des densités plus élevées que leurs homologues trans.
Habituellement, dans les systèmes acycliques, les isomères CIS sont plus instables que les isomères trans. La raison en est l'augmentation de l'interaction stérique défavorable des substituants dans les isomères cis. En général, les isomères cis ont une solubilité plus élevée dans les solvants inertes.
Qu'est-ce que trans?
Le préfixe «trans» est dérivé du latin. Cela signifie «sur les côtés adverses». Dans l'isomère trans, les groupes de substituants sont placés sur différents côtés d'un plan à double liaison ou d'un cycle non aromatique.
Le point d'ébullition des isomères trans est inférieur à celui des isomères cis. La différence est plus significative dans les substances avec des liaisons polaires. Dans l'isomère trans de 1,2-dichloroéthène, les deux moments de liaison C-Cl s'annulent et la molécule a un dipôle net zéro. En conséquence, il n'y a pas de forces dipolaires intermoléculaires, qui diminuent le point d'ébullition.
La symétrie des molécules est la clé de la détermination du point de fusion, en raison du meilleur emballage des substances solides. Les exemples de cela sont l'acide oléique (isomère cis) et l'acide éledidique (isomère trans). Le point de fusion de l'isomère cis est 13.4 ° C, l'isomère trans fond à 43 ° C. La raison en est que l'isomère trans est plus droite, s'accumule mieux, et donc - ayant un point de fusion beaucoup plus élevé.
Les isomères trans ont des densités plus faibles que leurs homologues cis. Dans les systèmes acycliques, les isomères trans sont plus stables que les isomères cis. En général, les isomères cis ont une solubilité plus élevée dans les solvants inertes.
Différence entre cis et trans
-
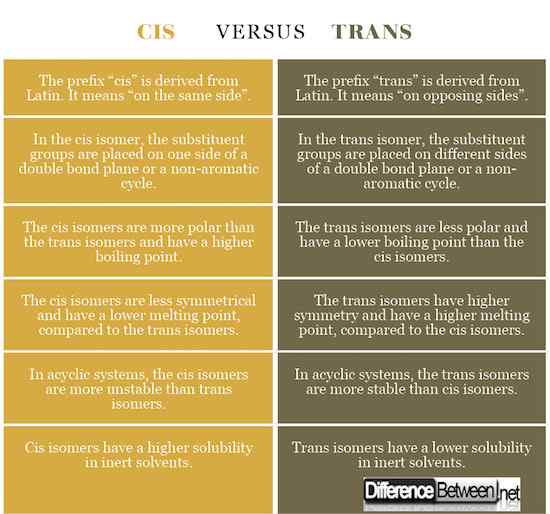
Définition de cis et trans
CIS: Le préfixe «cis» est dérivé du latin. Cela signifie «du même côté». Dans l'isomère cis, les groupes de substituants sont placés d'un côté d'un plan à double liaison ou d'un cycle non aromatique.
Trans: Le préfixe «trans» est dérivé du latin. Cela signifie «sur les côtés adverses». Dans l'isomère trans, les groupes de substituants sont placés sur différents côtés d'un plan à double liaison ou d'un cycle non aromatique.
-
Pollarité et point d'ébullition des CI et trans
CIS: La polarité provoque une augmentation des forces intermoléculaires, ce qui entraîne une augmentation du point d'ébullition. Les isomères cis, qui sont plus polaires que les isomères trans, ont un point d'ébullition plus élevé.
Trans: Les isomères trans sont moins polaires et ont un point d'ébullition inférieur que les isomères cis. La différence est plus significative dans les substances avec des liaisons polaires.
-
Point de symétrie et de fusion des cis et trans
CIS: Les isomères cis sont moins symétriques et ont un point de fusion plus faible, par rapport aux isomères trans.
Trans: Les isomères trans ont une symétrie plus élevée et un point de fusion plus élevé, par rapport aux isomères cis.
-
Stabilité et solubilité de CIS et trans
CIS: Dans les systèmes acycliques, les isomères CIS sont plus instables que les isomères trans. Ils ont une solubilité plus élevée dans les solvants inertes.
Trans: Dans les systèmes acycliques, les isomères trans sont plus stables que les isomères cis. Ils ont une solubilité inférieure dans les solvants inertes.
Résumé CIS VS. Trans:
- L'isomérisme CIS-Trans consiste en possibilité de placer des groupes de substituants sur un ou sur différents côtés d'un plan à double liaison ou d'un cycle non aromatique.
- L'existence distincte de cis et d'isomères trans n'est possible qu'en raison de la barrière énergétique élevée de la rotation autour de la double liaison. Ils se trouvent à la fois parmi les composés organiques et inorganiques.
- Les préfixes «cis» et trans sont dérivés du latin. CIS signifie «du même côté», trans signifie «sur les côtés adverses».
- Dans l'isomère cis, les groupes de substituants sont placés d'un côté, tandis que dans l'isomère trans, les groupes de substituants sont placés sur différents côtés d'un plan à double liaison ou d'un cycle non aromatique.
- La polarité provoque une augmentation des forces intermoléculaires, ce qui entraîne une augmentation du point d'ébullition. Les isomères cis sont plus polaires que les isomères trans et ont un point d'ébullition plus élevé. La différence est plus significative dans les substances avec des liaisons polaires.
- Les isomères cis sont moins symétriques et ont un point de fusion plus faible, par rapport aux isomères trans.
- Dans les systèmes acycliques, les isomères CIS sont plus instables que les isomères trans. Ils ont une solubilité plus élevée dans les solvants inertes.