Différence entre colloïd et suspension
- 4590
- 1144
- Juliette Lacroix
Les systèmes de dispersion se composent de deux ou plusieurs composés chimiques ou substances simples, appelées composants du système, distribués entre eux. Elles forment:
- Phase dispersée - la substance dispersée;
- Milieu continu - la substance dans laquelle la phase dispersée est distribuée.
Selon la taille des particules de la phase dispersée, il y a:
- Systèmes de dispersion hétérogène (rugueux) - Les particules sont plus grandes que 100 nm:
- Suspension - un composant liquide et solide;
- Émulsion - deux composantes liquides;
- Aérosol - le milieu de dispersion est un gaz.
- Colloïdes - La taille des particules se situe entre 1 et 100 nm;
- Solutions réelles - La taille des particules est inférieure à 1 nm.

Qu'est-ce que le colloïde?
Solutions d'eau de nombreuses substances (sucre, etc.), passer facilement à travers des barrières semi-perméables végétales ou animales, tandis que d'autres tels que la gélatine ne les traversent pas. Les premières substances sont appelées cristalloïdes, et les secondes sont appelées colloïdes.
Selon la façon dont les particules de la phase dispersée se réfèrent au milieu, les systèmes colloïdes sont:
- Lyophile - adsorbe un grand nombre de molécules du milieu de dispersion (gélatine, savons, Fe (OH)3, Al (oh)3));
- Lyophobe - Ne liez pas ou ne vous liez pas avec un petit nombre de molécules du milieu de dispersion (sels de certains métaux, sulfures métalliques mal solubles, etc.).
Selon la structure des particules colloïdes, les systèmes colloïdes sont subdivisés en:
- Associé (micellaire) - Les particules sont des groupes d'atomes, d'ions ou de molécules (e.g. chlorure de sodium dans le benzène);
- Moléculaire - Les particules sont des molécules d'un composé ayant une masse moléculaire élevée (e.g. amidon).
Selon la nature du milieu, les colloïdes sont:
- Hydrosols - Le solvant est de l'eau;
- Benzénosols - Le solvant est le benzène;
- EtherOsols - Le solvant est éther, etc.
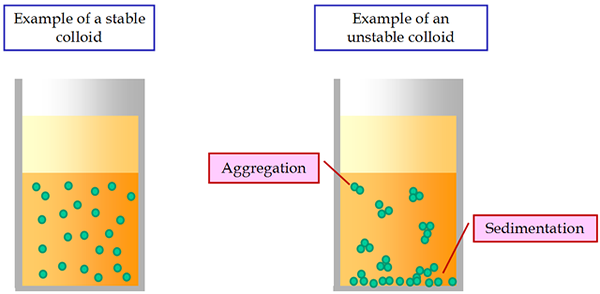
Les propriétés optiques des colloïdes se manifestent comme une coloration, une opalescence et un effet tindal. Ils sont dus à des différences dans l'absorption et la dispersion de la lumière des particules colloïdales.
Les particules colloïdales sont plus grandes et plus lourdes que les ions et la plupart des molécules, donc leur diffusion et leur pression osmotique sont faibles.
Une propriété cinétique caractéristique des colloïdes est le mouvement brownien. Les systèmes colloïdes sont moins stables que celui des solutions ordinaires. Sous un courant électrique constant, toutes les particules de colloïd se déplacent vers l'électrode à charte opposée correspondante. Ce phénomène est appelé électrophorèse.
Les sols de colloïdes moléculaires sont obtenus de manière analogue aux solutions réelles. Au contact de la phase dispersée se dissout spontanément dans le milieu dispersé. Les sols des colloïdes associés sont obtenus par diverses méthodes de dispersion et de condensation.
- Méthodes de dispersion - Dispersion du matériau à la taille des particules colloïdales en présence d'un milieu de dispersion;
- Méthodes de condensation - condensation (regroupement) molécules, atomes ou ions individuels dans des particules de taille colloïde.
Qu'est-ce que la suspension?
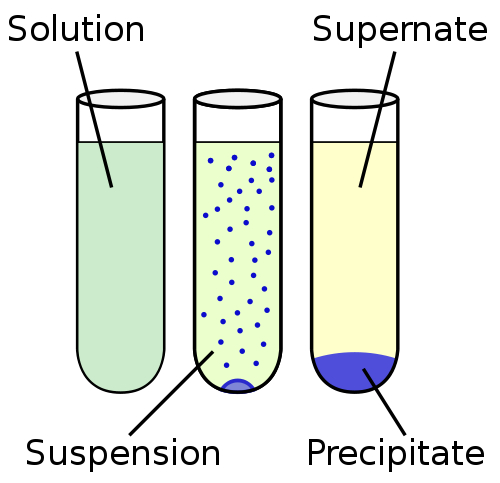
La suspension est un liquide hétérogène, contenant des particules solides insolubles qui sont suffisamment grandes pour se régler mais pendant un certain temps sont présentes tout au long du volume de la matrice liquide. Les particules sont plus grandes que 100 nm.
La classification des suspensions est basée sur la phase dispersée et le support de dispersion.
La suspension est plus proche de l'insolubilité du continuum de solubilité. À l'autre extrémité du continuum de solubilité est la solution, où les particules sont complètement mélangées et aucune phase solide n'est observée. Le continuum de solubilité est généralement organisé dans l'ordre: insolubilité, sédimentation, suspension, colloïd et solution.
La phase solide de la suspension est dispersée dans la phase liquide par un processus d'agitation mécanique au moyen d'un agent inerte ou faiblement actif utilisé comme agent de suspension. Contrairement aux colloïdes, les suspensions s'installent avec le temps. Un exemple d'une suspension précipitée rapidement est le sable et l'eau.
Une propriété caractéristique des suspensions est leur inhomogénéité optique, qui est exprimée par la turbidité. La turbidité est un signe externe intégral de la suspension et est déterminé par la présence de particules insolubles qui sont imperméables à la lumière. Le degré de turbidité des suspensions est différent. Il est déterminé par la concentration de la phase en suspension et le degré de sa dispersion (taille des particules).
L'une des caractéristiques les plus importantes des suspensions est leur instabilité de sédimentation. Il s'exprime dans l'inévitable décantation des particules en suspension sous l'influence de la gravité. Les particules peuvent se déposer par elles-mêmes, sans rester ensemble. Dans ce cas, il y a une stabilité agrégative de la suspension.
Si les particules de décantation restent ensemble sous l'influence des forces moléculaires de cohésion et forment des agrégats, il y a une instabilité agrégative de suspensions. Ainsi, les suspensions sédimentations instables peuvent être globalement stables ou instables.
Parfois, dans des suspensions coagulées, de gros flocons se forment qui sont mal mouillés par le milieu de dispersion et flottent à la surface. Ce phénomène est appelé floculation.
L'instabilité de sédimentation des suspensions dans la pratique entraîne une perturbation progressive de la composition uniforme avant le dépôt complet de la phase insoluble.
Il y a aussi des suspensions, ayant la capacité de rester dans un état suspendu pendant longtemps. Ils sont appelés suspensions stables.
Les suspensions sont obtenues par diverses méthodes de dispersion et de condensation.
Différence entre colloïd et suspension
-
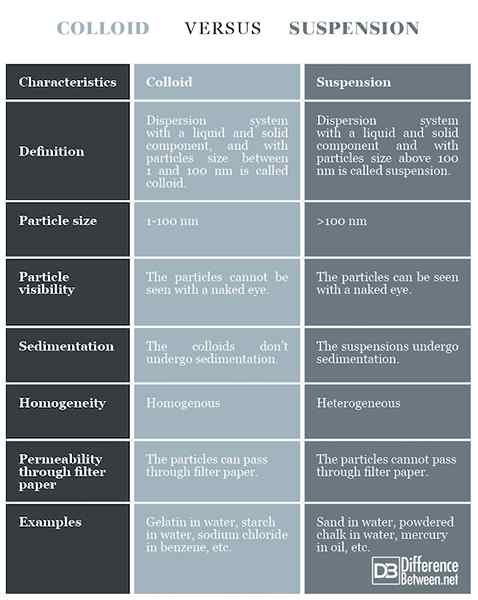
Définition
Colloïde: Le système de dispersion avec un composant liquide et solide, avec une taille de particules entre 1 et 100 nm est appelé colloïd.
Suspension: Le système de dispersion avec un composant liquide et solide, avec une taille de particules supérieure à 100 nm est appelé suspension.
-
La taille des particules
Colloïde: La taille des particules est de 1 à 100 nm.
Suspension: La taille des particules est supérieure à 100 nm.
-
Visibilité des particules
Colloïde: Les particules dans le colloïd ne peuvent pas être vues à l'œil nu.
Suspension: Les particules de la suspension peuvent être vues à l'œil nu.
-
Sédimentation
Colloïde: Les colloïdes ne subissent pas de sédimentation.
Suspension: Les suspensions subissent une sédimentation.
-
Homogénéité
Colloïde: Les colloïdes sont relativement homogènes.
Suspension: Les suspensions sont hétérogènes.
-
Perméabilité à travers le papier filtre
Colloïde: Les particules colloïdes peuvent passer par du papier filtre.
Suspension: Les particules de suspension ne peuvent pas passer par du papier filtre.
-
Exemples
Colloïde: Gélatine dans l'eau, amidon dans l'eau, chlorure de sodium dans le benzène, etc.
Suspension: Sable dans l'eau, craie en poudre dans l'eau, mercure dans l'huile, etc.
Graphique de comparaison des colloïdes et des suspensions
Résumé du colloïd et de la suspension
- Les systèmes de dispersion se composent de deux ou plusieurs composés chimiques ou substances simples, appelées composants du système, distribués entre eux. Ils forment une phase dispersée et un milieu continu.
- Le système de dispersion avec un composant liquide et solide, avec une taille de particules entre 1 et 100 nm est appelé colloïd.
- Le système de dispersion avec un composant liquide et solide, avec une taille de particules supérieure à 100 nm est appelé suspension.
- Les particules dans le colloïd ne peuvent pas être vues à l'œil nu, tandis que les particules de la suspension peuvent être vues à l'œil nu.
- Les colloïdes ne subissent pas de sédimentation, tandis que les suspensions subissent une sédimentation.
- Les colloïdes sont relativement homogènes, tandis que les suspensions sont hétérogènes.
- Les particules colloïdes peuvent passer par du papier filtre, tandis que les particules des suspensions ne peuvent pas.
- Des exemples de colloïdes sont la gélatine dans l'eau, l'amidon dans l'eau, le chlorure de sodium dans le benzène, etc. Des exemples de suspensions sont le sable dans l'eau, la craie en poudre dans l'eau, le mercure dans l'huile, etc.

