Différence entre cristalline et amorphe

- 1045
- 73
- Lena Pons
Amorphes et cristallins sont deux états qui décrivent les solides typiques en chimie. En utilisant des expériences de diffraction des rayons X, la structure des solides peut être classée en cristalline ou amorphe (non cristallin).
Les solides sont parmi les trois états de base de la matière qui comprennent des liquides et des gaz. Ils sont caractérisés par une structure rigide de molécules, d'ions et d'atomes disposés de manière ordonnée ou non ordonnée. Ces arrangements ordonnés ou non ordonnés ont conduit à la catégorisation comme amorphe et cristalline et cet article dépasse les principales différences entre les deux termes.

Qu'est-ce qui est cristallin?
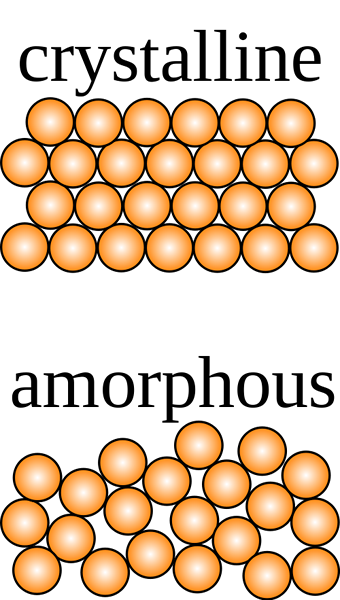
Un solide cristallin est celui dans lequel les particules constituantes sont disposées ordonnées dans un motif tridimensionnel appelé réseau cristallin avec des forces intermoléculaires uniformes, et les particules se croisent à des angles caractéristiques du cristal.
La structure interne a une forme géométrique distincte, et il montre un clivage clair lorsqu'il est coupé n'importe où dans la structure. Le modèle tridimensionnel observé à l'aide des rayons X est utilisé pour identifier le solide. Il n'est cependant pas facile de détecter la différence entre les solides cristallins et non cristallins en les touchant. Ils diffèrent les uns des autres sous de nombreux aspects, y compris les propriétés chimiques et physiques.
Les solides cristallins (cristaux) ont besoin de températures extrêmes pour briser les forces intermoléculaires. Ils ont une chaleur définitive de fusion et de points de fusion en raison de la disposition uniforme de leurs composants. L'environnement local est également uniforme. Cependant, lorsqu'ils sont coupés dans n'importe quelle direction, les propriétés physiques sont différentes ainsi connues comme anisotrope. Lorsqu'il est tourné autour de l'axe, la structure des cristaux reste la même et c'est appelé disposition symétrique des molécules, des atomes ou des ions.
Certains solides cristallins peuvent finir par être amorphes en fonction du processus de refroidissement. D'autres peuvent faire mal aligné leurs composants en raison de la présence d'impuretés. De plus, les substances de refroidissement peuvent rapidement conduire à une structure amorphe aux formes géométriques irrégulières. Le quartz, par exemple, est cristallin avec des atomes de silicone et d'oxygène de manière ordonnée. Mais, lorsqu'il est refroidi rapidement, cela peut entraîner le verre de structure amorphe. Il arrive normalement que le processus de cristallisation est évité en faisant fondre rapidement des substances pour produire des solides amorphes en raison de leurs applications industrielles étendues. Le caoutchouc, le polymère et le verre sont parmi les exemples parfaits de solides amorphes importants largement utilisés pour leurs immenses avantages et leurs propriétés isotropes uniques.
L'indice de réfraction, la résistance mécanique, la conductivité thermique et la conductivité électrique des solides cristallins diffèrent dans différentes directions. C'est l'inconvénient de ces types de solides par rapport aux solides non cristallins. Le bon côté d'un solide anisotrope est qu'il désigne une structure interne parfaitement disposée avec des forces uniformes d'attractions dans un réseau cristallin. Il représente les vraies propriétés d'un solide avec un ordre à longue portée et une structure rigide.
Qu'est-ce que l'amorphe?
Le mot amorphe est dérivé du mot grec amorphe qui signifie «sans forme». Il s'agit de l'arrangement informe, désordonné et irrégulier des particules constituantes d'un solide. Leurs forces inter-moléculaires ne sont pas les mêmes, et les distances entre les particules. Lorsqu'ils sont clivés, les solides amorphes donnent des fragments ou des surfaces incurvées en raison de formes géométriques irrégulières.
Certains solides amorphes peuvent avoir des parties de motifs disposés ordonnés qui sont appelés cristallites. Les atomes, les ions ou les molécules du solide dépendent du processus de refroidissement. Comme indiqué susmentionné, le cristal de quartz diffère avec du verre de quartz en raison du processus de cristallisation. Mais, généralement, de nombreux solides amorphes ont un schéma désordonné. Ils sont généralement appelés les solides super refroidis car la structure partage certaines propriétés avec des liquides. De plus, ils ne montrent pas les véritables propriétés des solides, mais sont néanmoins principalement utilisés dans de nombreuses applications.
La conductivité thermique, la résistance mécanique, la conductivité électrique et l'indice de réfraction sont les mêmes dans toutes les directions de solides amorphes. Cela explique d'où vient le nom isotrope. Les solides n'ont pas de points de fusion nets ou une chaleur définitive de fusion. Une large gamme de températures doit être appliquée avant de pouvoir fondre en raison de l'absence d'un tableau ordonné de composants. De plus, les solides amorphes sont caractérisés par un ordre à courte portée. Des exemples de solides amorphes comprennent des polymères, des caoutchoucs, des plastiques et du verre.
Si un solide amorphe est laissé pendant longtemps en dessous de son point de fusion, il peut se transformer en un solide cristallin. Il peut représenter les mêmes propriétés possédées par les solides cristallins.
Différences clés entre amorphes et cristallins
Structure de cristalline et amorphe
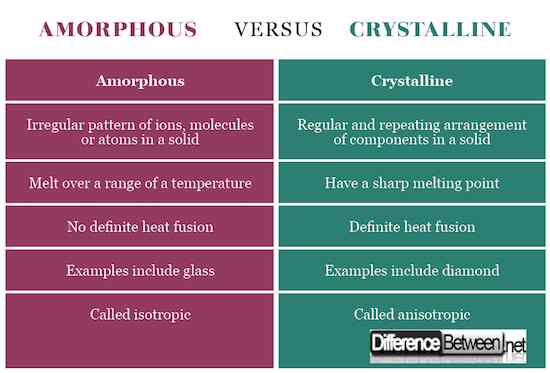
Les solides cristallins ont une forme définitive avec des ions, des molécules ou des atomes disposés ordonnés dans un motif tridimensionnel souvent appelé réseau cristallin. S'ils sont coupés, ils représentent un clivage clair avec des surfaces se croisant à des angles qui sont caractéristiques du cristal. Les solides amorphes, en revanche, ont un tableau désordonné de composants ne montrant pas une forme définie. Lorsqu'ils sont coupés, ils présentent des formes irrégulières généralement avec des surfaces incurvées. Les composants cristallins sont maintenus ensemble par des forces intermoléculaires uniformes alors que dans les solides amorphes, ces forces diffèrent d'un atome à l'autre.
Points de fusion de cristalline et amorphe
Les solides amorphes n'ont pas de points de fusion définis mais fondent sur une large gamme de températures en raison de la forme irrégulière. Les solides cristallins, en revanche, ont un point de fusion pointu.
Propriétés physiques de cristalline et amorphe
Les solides cristallins possèdent une conductivité électrique différente, une conductivité thermique, un indice de réfraction et une résistance mécanique dans un cristal dans différentes directions, donc ils sont appelés anisotropes. Les amorphes sont appelés isotropes en raison de propriétés physiques similaires de l'une ou l'autre direction.
Exemples de cristalline et amorphe
Les exemples d'un solide cristallin comprennent le NaCl, le sucre et le diamant alors que les exemples de solides amorphes comprennent le verre, le caoutchouc et les polymères.
Voir le tableau de comparaison des versets cristallins amorphes ci-dessous:
Résumé des vers cristallins amorphes
- Les solides cristallins ont un modèle régulier à trois dimensions d'ions, d'atomes ou de molécules tandis que les solides amorphes ont une disposition aléatoire de ces composants
- Les solides cristallins ont un point de fusion exact tandis que les solides amorphes fondent sur une plage de température
- Les solides amorphes donnent des fragments avec des motifs irréguliers lorsqu'ils sont clivés alors que les solides cristallins représentent une forme définie
- Cristallin appelé anisotrope en raison de différentes propriétés physiques dans toutes les directions alors que les amorphes sont appelés isotropes
- Les exemples d'amorphes incluent le verre et celui de cristallin incluent le diamant.

