Différence entre électrophile et nucléophile
- 2022
- 2
- Juliette Paul
Les électrophiles et les nucléophiles sont les deux concepts importants de la chimie organique qui aident à décrire les réactions chimiques entre les accepteurs d'électrons et les donneurs. Ces deux termes ont été introduits en 1933 par Christopher Kelk Ingold et ils ont servi de remplacements pour les termes cationoïdes et anionoïdes qui ont été introduits en 1925 par un.J. Lapworth.
Depuis lors, des études approfondies ont été entreprises pour comprendre les différentes entre électrophiles et nucléophiles. Cet article démystifie la différence entre ces deux concepts. En un mot, un nucléophile est un donneur d'électrons alors qu'un électrophile est un accepteur d'électrons.
Qu'est-ce qu'un électrophile?
Pour décomposer le terme, le mot «électro» provient des électrons et le mot latin «phile» fait référence à «aimer». En termes simples, cela signifie amoureux des électrons. C'est un réactif qui se caractérise par une faible densité d'électrons dans sa coquille de canton. L'ion hydrogène dans les acides et le méthyl-carbocation sont des exemples de substances électrophiles. Ils sont déficients en électrons.
Un électrophile est facilement détecté par une charge positive ou une charge neutre avec des orbitales vides (sans satisfaire la règle des octets). Les électrons se déplacent d'une zone de haute densité à celle à faible densité, et contrairement aux charges s'attirent. Cette théorie explique l'attraction des électrons par les atomes, molécules ou ions électrophiles déficients en électrons. Par définition, un électrophile est appelé interchangeable un acide de Lewis car il accepte les électrons en ligne avec la définition de l'acide.
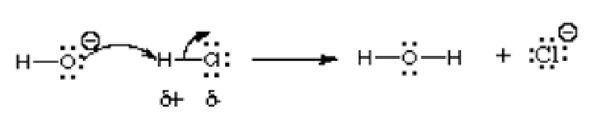
La réaction et les composés ci-dessous montrent les exemples d'électrophiles:

Dans cette réaction, l'ion hydroxyde réagit avec le chlorure d'hydrogène; Ainsi un acide réagit avec une base. Comme indiqué par la flèche, l'atome d'oxygène plus électronégatif donne des électrons à l'atome d'hydrogène déficiente en électrons. Il partage une paire isolée à l'atome d'hydrogène qui porte une charge positive dans le chlorure d'hydrogène composé car est plus électronégatif que l'hydrogène. Cette réaction est un fondamental de nombreuses réactions de chimie organique, en particulier les réactions de base de Lewis Acid et Lewis. D'autres exemples sont représentés dans l'image suivante:
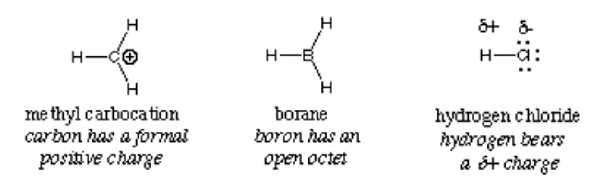
En général, un électrophile est identifié par une charge positive partielle comme dans le chlorure d'hydrogène, une charge positive formelle comme dans le carbocation méthyle ou les orbitales vacantes. Les molécules neutres polarisées telles que les halogénures d'acyle, les composés carbonyle et les halogénures alkyle sont des exemples typiques d'électrophiles.
Important: L'hydronium ion, bien qu'il porte une charge positive, ne se qualifie pas pour être classé comme électrophile en raison des orbitales vacants complètes dans sa coquille extérieure. Il donne des ions hydrogène et de l'eau. Il en va de même pour l'ion ammonium; il n'a pas d'orbitales vacantes qui peuvent attirer des électrons. En conséquence, ce n'est pas un électrophile.
Qu'est-ce qu'un nucléophile?
Le terme est décomposé en mot «nucléo» qui fait référence au noyau et au mot latin «Phile» qui signifie aimer. Cela signifie simplement l'amour du noyau. Les nucléophiles sont riches en électrons et, comme donc, donnent des paires d'électrons aux électrophiles pour former des liaisons covalentes dans les réactions chimiques. Ces substances sont mieux remarquées avec des paires solitaires, des obligations Pi et des charges négatives. Les ions d'ammoniac, d'iodure et d'hydroxyde sont des exemples de substances nucléophiles.
Par définition, un nucléophile est appelé interchangeable la base de Lewis car ils donnent tous des électrons et acceptent les protons. L'image ci-dessous représente les exemples de nucléophiles:
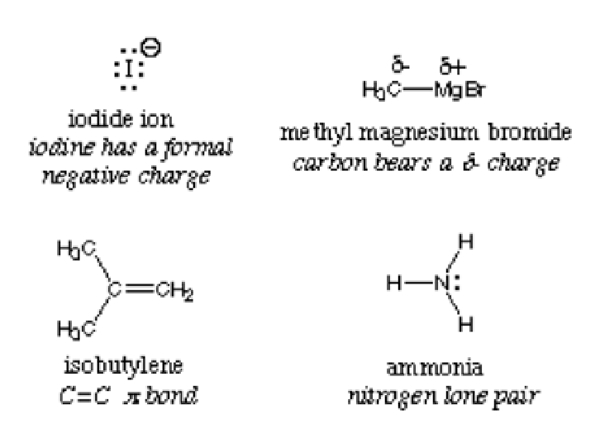
Le centre nucléophile d'un composé est détecté avec l'atome le plus électronégatif. Considérez l'ammoniac NH3; L'azote est plus électronégatif et attire ainsi des électrons au centre. Le composé a une densité électronique élevée et, lorsqu'il réagit avec un électrophile, disons de l'eau, il fait don d'électrons. H2O peut agir à la fois comme électrophile ou nucléophile en fonction du composé ou de la molécule avec laquelle il réagit.
Considérez l'image ci-dessous:
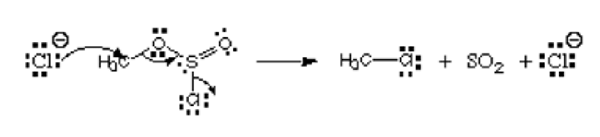
Depuis l'image, le premier atome, le chlorure Ion donne sa seule paire au carbone pour former une liaison covalente. Il a la charge négative et donne des électrons, et il est donc considéré comme le nucléophile. Cet atome de chlore qui quitte l'ester chlorosulfite est nommé le groupe de départ. Ce n'est pas un électrophile ou un nucléophile.
Différence clé entre électrophile et nucléophile
Définition de l'électrophile et des nucléophiles
Un électrophile est un acide Lewis qui accepte les électrons d'un atome, d'ion ou de molécule riche en électrons. En acceptant les électrons, il forme une liaison covalente. Ce réactif souvent identifié par charge positive partielle, charge positive formelle ou atome neutre, ion ou molécule qui ne satisfait pas à la règle des octets. Un nucléophile, en revanche, est un atome, un ion ou une molécule qui a une forte densité d'électrons. Il donne une paire seule à l'électrophile pour former une liaison covalente. Il est identifié par des charges positives et des électrons libres dans son orbitale.
Réactions chimiques de l'électrophile et des nucléophiles
Un nucléophile est impliqué dans la substitution nucléophile et l'addition tandis qu'un électrophile est impliqué dans une substitution électrophile et un ajout.
Identité de charge dans l'électrophile et les nucléophiles
Un électrophile peut être chargé de manière neutre ou positive alors que le nucléophile peut être chargé de manière neutre ou négative. Un électrophile accepte les électrons, par conséquent, il est appelé l'acide de Lewis alors qu'un nucléophique donne des électrons, d'où il est appelé la base de Lewis.
Versets électrophiles Nucléophile: Tableau de comparaison

Résumé des versets électrophiles nucléophiles
- Un électrophile est un atome déficiente en électrons, une ou une molécule tandis que le nucléophile est un atome, une molécule ou un ion riche en électrons
- Un électrophile peut être chargé positivement ou neutre tandis que le nucléophile peut être chargé négativement ou neutre
- Un électrophile est appelé l'acide Lewis et le nucléophile est appelé la base de Lewis
- Un électrophile accepte les électrons et donne des protons tandis qu'un nucléophique donne des électrons et accepte des protons.

