Différence entre les spectres d'émission et d'absorption
- 4158
- 270
- Juliette Lacroix

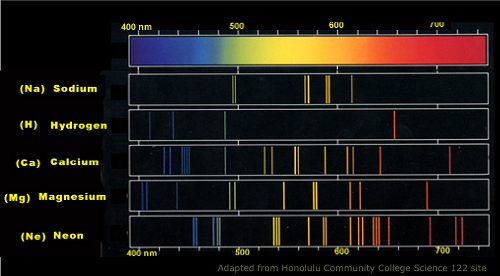
Spectre d'émission atomique de sodium
Émission vs. Spectres d'absorption
Un chimiste visant à découvrir la composition élémentaire d'une substance ou d'une solution spécifique peut différencier les atomes par spectroscopie d'émission et / ou d'absorption. Les deux processus sont axés sur l'observation des électrons et des photons lorsqu'ils sont soumis à une lumière. Un spectrophotomètre avec une source de lumière est alors nécessaire dans ces processus. Le scientifique doit avoir une liste de valeurs pour les deux émissions d'absorption pour chaque atome avant de soumettre la substance à la spectroscopie.
Par exemple, lorsque le scientifique découvre un échantillon d'une zone éloignée et vise à apprendre la composition de la question, il peut choisir de soumettre l'échantillon à une spectroscopie d'émission ou d'absorption. Dans les spectres d'absorption, il est censé observer comment les électrons des atomes absorbent l'énergie électromagnétique de la source lumineuse. Lorsque la lumière est dirigée vers des atomes, des ions ou des molécules, les particules ont tendance à absorber les longueurs d'onde qui peuvent les exciter et les faire passer d'un quantum à un autre. Le spectrophotomètre peut enregistrer la quantité de longueur d'onde absorbée, et le scientifique peut ensuite se référer à la liste des caractéristiques des éléments pour déterminer la composition de l'échantillon recueilli.
Les spectres d'émission sont effectués avec le même processus de soumission de lumière. Dans ces processus, cependant, le scientifique observe la quantité d'énergie de lumière ou de chaleur émise par les photons de l'atome qui les fait revenir à leur quantum d'origine.
Pensez-y de cette façon: le soleil est le centre de l'atome, composé de photons et de neutrons. Les planètes en orbite autour du soleil sont les électrons. Lorsqu'une lampe de poche géante est dirigée vers la Terre (comme un électron), la Terre devient excitée et se déplace vers l'orbite de Neptune. L'énergie absorbée par la Terre est enregistrée dans les spectres d'absorption.
Lorsque la lampe de poche géante est supprimée, la Terre émet alors la lumière pour qu'il revienne à son état d'origine. Dans de tels cas, le spectrophotomètre enregistre la quantité de longueur d'onde émise par la Terre afin que le scientifique détermine le type d'éléments composé par le système solaire.
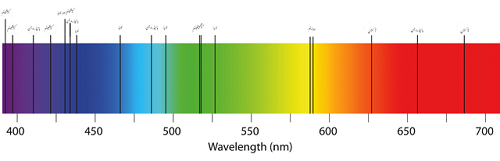
Spectre d'absorption de quelques éléments
En plus de cela, l'absorption n'a pas besoin de l'excitation des ions ou des atomes, contrairement aux spectres d'émission. Les deux ont besoin d'avoir une source de lumière, mais celles-ci devraient varier dans les deux processus. Les lampes en quartz sont généralement utilisées dans l'absorption, tandis que les brûleurs conviennent aux spectres d'émission.
Une autre différence entre les deux spectres réside dans la sortie «imprimer». En développant une image, par exemple, le spectre d'émission est la photographie colorée, tandis que le spectre d'absorption est l'impression négative. Voici pourquoi: les spectres d'émission peuvent émettre de la lumière qui s'étend aux différentes gammes du spectre électromagnétique, produisant ainsi des lignes colorées avec des ondes radio à faible énergie vers des rayons gamma plus énergique. Les couleurs du prisme sont généralement observées dans ces spectres.
D'un autre côté, l'absorption peut émettre plusieurs couleurs couplées avec des lignes vierges. En effet. Il est peu probable que la lumière rééminée dans le processus soit émise dans la même direction que le photon absorbé est originaire de. Étant donné que la lumière de l'atome ne peut pas être dirigée vers le scientifique, les lumières semblent avoir des lignes noires en raison des vagues manquantes dans les spectres électromagnétiques.
Résumé:
1.Les spectres d'émission et d'absorption peuvent tous deux être utilisés pour déterminer la composition de la matière.
2.Les deux utilisent une source lumineuse et un spectrophotomètre.
3.Les spectres d'émission mesurent la longueur d'onde de la lumière émise après que les atomes sont excités par la chaleur, tandis que l'absorption mesure la longueur d'onde absorbée par l'atome.
4.Les spectres d'émission émettent toutes les couleurs du spectre électromagnétique, tandis que l'absorption peut manquer quelques couleurs en raison de la redirection de la réémission des photons absorbés.
- « Différence entre les habiletés motrices brutes et fines
- Différence entre l'épidémiologie et l'étiologie »

