Différence entre la formule empirique et moléculaire
- 3742
- 592
- Mlle Lina Schmitt
 En chimie, il existe plusieurs façons d'exprimer un composé chimique. Vous pouvez utiliser son nom commun, comme le chlorure de sodium ou le benzène, ou vous pouvez choisir de l'exprimer dans une formule chimique. Une formule chimique contient plus d'informations sur un composé chimique que son nom commun. Une formule chimique vous indique des informations sur les atomes spécifiques qui composent un composé chimique particulier.
En chimie, il existe plusieurs façons d'exprimer un composé chimique. Vous pouvez utiliser son nom commun, comme le chlorure de sodium ou le benzène, ou vous pouvez choisir de l'exprimer dans une formule chimique. Une formule chimique contient plus d'informations sur un composé chimique que son nom commun. Une formule chimique vous indique des informations sur les atomes spécifiques qui composent un composé chimique particulier.
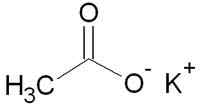
Les deux formules chimiques les plus couramment vues sont la formule empirique et la formule moléculaire. Les deux formules vous disent quels éléments constituent un composé chimique spécifique. Par exemple, H2O (à la fois une formule moléculaire et une formule empirique) a des molécules d'hydrogène (H) et des molécules d'oxygène (O). En regardant le cacl (chlorure de calcium), vous saurez qu'il contient des atomes de calcium (CA) et de chlore (Cl).
Les formules moléculaires et empiriques diffèrent par les nombres de leur indice. L'indice est le «2» dans H2O. Pour une formule moléculaire, l'indice décrit le nombre total d'atomes dans une molécule particulière. L'hexane, une molécule avec six atomes de carbone et quatorze atomes d'hydrogène est exprimé en C6H14 dans une formule moléculaire. Pour une formule empirique, l'indice décrit le rapport des atomes dans une molécule particulière. Encore une fois, l'hexane avec ses six atomes de carbone et ses quatorze atomes d'hydrogène serait désormais exprimé C3H7 parce que c'est le rapport de 6:14.
Dans les manuels de chimie du secondaire, il est plus courant de voir une formule empirique qu'une formule moléculaire. Les formules empiriques décrivent également les composés ioniques et les macromolécules. Les composés ioniques sont des molécules maintenues ensemble par la force électrostatique qui est créée lorsqu'un atome chargé négativement réagit avec un atome chargé négativement. Les macromolécules sont de grandes molécules telles que les acides nucléiques et les protéines. La formule empirique est particulièrement utile pour exprimer proprement la formule des macromolécules. Sans la formule empirique, les nombres de l'indice ont le potentiel de devenir énorme.
La formule empirique peut être utilisée en physique et en chimie. En physique, la formule empirique agit comme une équation mathématique. Cette équation est utilisée pour prédire les résultats observables dans les tests sur les mouvements et les interactions des atomes.
Résumé
1. Les formules empiriques et moléculaires sont deux formules chimiques.
2. La formule moléculaire répertorie tous les atomes d'une molécule tandis que la formule empirique montre le rapport le nombre d'atomes dans une molécule.
3. Des formules empiriques sont utilisées pour décrire les composés ioniques et les macromolécules.
4. Les formules empiriques sont utilisées comme équations mathématiques en physique.

