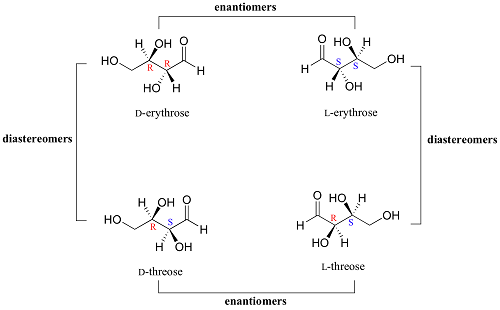
Différence entre les énantiomères et les diastéréomères
- 4069
- 442
- Lena Muller

Le défi de nombreux étudiants en chimie étudiant la stéréochimie émerge dans la distinction entre les énantiomères et les diastéréomères. Ce sont des composés moléculaires courants avec des caractéristiques différentes bien qu'ils soient les stéréoisomères - composés avec la même formule moléculaire et structurelle mais une orientation différente des atomes. Cet article expliquera la différence entre ces deux composés communs pour vous éclairer.
Tout d'abord, qu'est-ce que la stéréochimie? C'est l'étude de la disposition spatiale des atomes dans un composé. Les énantiomères et les diastéréomères font partie des stéréoisomères - même formule structurelle et moléculaire avec une disposition différente des atomes dans chacun. Notez que les stéréoisomères peuvent inclure de nombreux composés en dehors des énantiomères et des diastéréomères. Ceux-ci peuvent inclure les conformères et les atropisomères. Entre autres, nous nous concentrons sur les diastéréomères et les énantiomères.
Que sont les énantiomères?
Ce sont les molécules chirales qui se reflètent des images les unes des autres et ne sont pas superposables. Une molécule chirale a une image qui n'est pas la même que son image miroir et elle est généralement caractérisée par un centre de carbone avec 4 atomes différents liés. Ces atomes doivent être chimiquement distinctibles pour qu'une molécule soit qualifiée comme chiral et donc énantiomère. Le carbone tétraédrique auquel les différents atomes sont attachés est appelé le stéréocentre. Voir la différence ci-dessous entre un carbone considéré comme chiral et celui qui ne se qualifie pas.
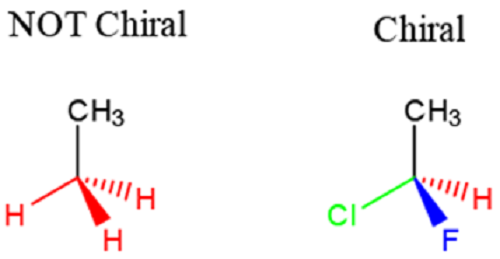
Fig 1: Une illustration de la molécule chirale et non chirale [1]
Parce qu'il y a une légère différence dans la disposition spatiale des atomes des molécules d'énantiomère, les Cahn-ingold-prélog Le système de dénomination a été établi. Les deux molécules ont la même formule et la structuration des atomes afin que pour les identifier, nous devons étiqueter l'une les S et l'autre R, en fonction de la configuration dans le sens horaire des atomes de la masse atomique la plus basse à la masse atomique la plus élevée. Par exemple, un carbone stéréocentre avec du brome, du chlore, du fluor et de l'hydrogène attachés respectivement dans le sens des aiguilles d'une montre, la molécule se verra attribuer un R, et si elle est anti-horloge, la molécule se verra attribuer un S car le brome a une masse atomique la plus élevée et hydrogène le plus bas.
La disposition de ces atomes aide en fait à déterminer les propriétés de la molécule. Considérez les structures de bromochloroflurométhane ci-dessous:
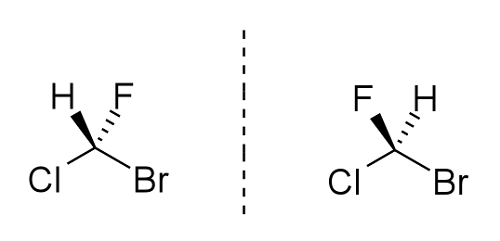
Il est évident que l'orientation de l'hydrogène et du fluor est différente mais du même composé moléculaire. Peu importe combien de fois vous pouvez faire pivoter la molécule droite, il n'aura jamais la même orientation que la molécule gauche. Si, par exemple, vous essayez d'échanger le fluor et l'hydrogène autour, le brome et le chlore changeront également leurs positions. Cela explique clairement les concepts d'images non superprimables et miroir des énantiomères.
Pour nommer les molécules, le chiral (stéréocentre) se voit attribuer une lettre S ou R. Les constituants, ainsi le fluor, le chlore, le brome, sont marqués d'une masse atomique élevée à faible attribuant 1, 2, 3. Le brome est le plus élevé, donc on est attribué 1, le chlore 2 et le fluor 3. Si la rotation est de 1 à 3 dans le sens des aiguilles d'une montre, le centre chiral est désigné r, si dans le sens antihoraire, alors s. C'est ainsi que le système Cahn-Ingold-Prolog fonctionne pour distinguer les énantiomères les uns des autres. Cela devient simple lorsque nous travaillons avec un centre chiral avec 4 substituants uniques qui y sont attachés. Un énantiomère peut avoir plus de 2 centres chiraux.
Les molécules des énantiomères sont distinctes en termes d'arrangement spatial des atomes, mais ont les mêmes propriétés chimiques et physiques. Cela dit, ils ont les mêmes points de fusion, les points d'ébullition et bien d'autres propriétés. Leurs forces intermoléculaires sont identiques - cela explique les mêmes propriétés. Mais leurs propriétés optiques sont différentes car elles tournent la lumière polarisée dans des directions opposées bien que en quantités égales. Cette différence dans les propriétés optiques distingue les molécules d'énantiomère.
Quels sont les diastéréomères?
Ce sont les composés stéréoisomères avec des molécules qui ne sont pas des images miroir les unes des autres et qui ne sont pas superposables. L'exemple parfait de diastéréomères est lorsque vous regardez les structures CIS et Trans Isomère. Voir les structures CIS-2-Butène et Trans-2-Butène ci-dessous:
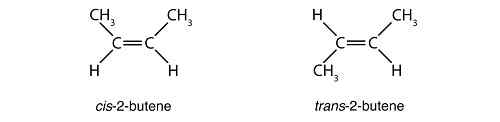
Les composés sont identiques mais la disposition est différente, et ce ne sont pas les images miroir les unes des autres. Quand le ch3 sont du même côté, le composé est cis Et lorsque l'autre est échangé avec l'atome d'hydrogène, nous nommons le composé trans. Mais le cis et trans Les structures ne sont pas les seuls exemples de diastéréomères. Il y a beaucoup de ces molécules, tant qu'elles démontrent les arrangements spatiaux des atomes qui ne sont pas des images miroir les uns des autres, et qui ne sont pas du sumperimposable.
Contrairement aux énantiomères, les diastéréomères ont des propriétés physiques et chimiques différentes. Les diastéréomères ont deux stéréocentres par lesquels l'autre structure moléculaire peut imiter les configurations d'énantiomère tandis que l'autre a la même configuration. C'est ce qui les distingue des énantiomères car il n'y a aucun moyen que ces structures puissent être des images miroir les unes des autres.
Le tableau ci-dessous mettra en évidence les principales différences entre les énantiomères et les diastéréomères en un mot:
| Énantiomères | Diastéréomères |
| Ce sont des images miroir les unes des autres et ne sont pas-superimposables | Ce ne sont pas des images miroir les unes des autres et ne sont pas superimables |
| Leurs structures moléculaires souvent conçues avec R et S pour les distinguer. | Une molécule imite les structures énantiomères tandis que l'autre a la même configuration. Il n'est donc pas nécessaire d'utiliser la dénomination pour les différencier. |
| Ont les mêmes propriétés chimiques et physiques mais différentes propriétés optiques | Avoir des propriétés chimiques et physiques différentes |
| Avoir un ou plusieurs stéréocentres | Avoir deux stéréocenteurs |
| Tous les énantiomères possèdent une activité optique active bien qu'ils tournent la lumière dans des directions opposées. Ceux qui tournaient la lumière dans le sens antihoraire sont connues sous le nom de levorotary, et celles tournantes dans le sens horaire sont appelées dextrorotaires. Mais lorsque l'autre a les mêmes quantités de rotation dextrorotaires et lévorotaires, elle est considérée comme un mélange de race et donc optiquement inactif. | Tous les diastéréomères ne possèdent pas d'activité optique |
Conclure!
Les énantiomères et les diastéréomères sont des stéréoisomères avec la même formule moléculaire et structurelle mais une disposition / configuration différente des atomes qui font leurs structures. Nous avons vu que les molécules d'énantiomère sont les images miroir les unes des autres et que les diastéréomères ne sont pas des images miroir. Les deux molécules ne sont pas sumperimposables.
Les énantiomères ont les mêmes propriétés chimiques et physiques mais diffèrent dans les propriétés optiques car certains tournent la lumière polarisée dans des directions opposées. D'un autre côté, tous les diastéréomères n'ont pas l'activité optique.
Nous avons également vu comment la dénomination des structures des énantiomères se déroule avec le système de dénomination R et S attribué sur la base de la masse atomique des substituants attachés au centre chiral. Dans les diastéréomères, une seule structure a la configuration R et S tandis que l'autre a les mêmes configurations. C'est ce qui les distingue des images de miroir énantiomère.

