Différence entre le point final et le point d'équivalence
- 3297
- 724
- Sarah Poirier
Le point de terminaison et le point d'équivalence sont les deux concepts les plus importants des titrages de chimie. La technique des titrages peut se produire dans les réactions redox, les réactions acides et bien d'autres réactions. Il est principalement utilisé dans les réactions acides où il implique la neutralisation d'une autre solution avec l'autre pour déterminer la concentration inconnue. Fondamentalement, une solution standard avec une concentration connue est soigneusement versée dans une autre solution appelée analyte avec une concentration inconnue pour calculer sa concentration.
Pendant le processus de titrage, il y a deux étapes atteintes, à savoir. point final et point d'équivalence. Le point d'équivalence, également appelé point stoichiométrique, en un mot, est un point où les moles des deux solutions, acide et base, sont équivalentes ou égales. L'étape se produit avant le point final, qui signale l'achèvement de la réaction. Dans certaines réactions, il pourrait y avoir de nombreux points d'équivalence, en particulier dans les acides polyprotiques et les bases où il existe plusieurs ions d'hydroxyde.
Cet article déroule la principale différence entre le point de terminaison et le point d'équivalence dans les titrages chimiques.

Définition du point d'équivalence
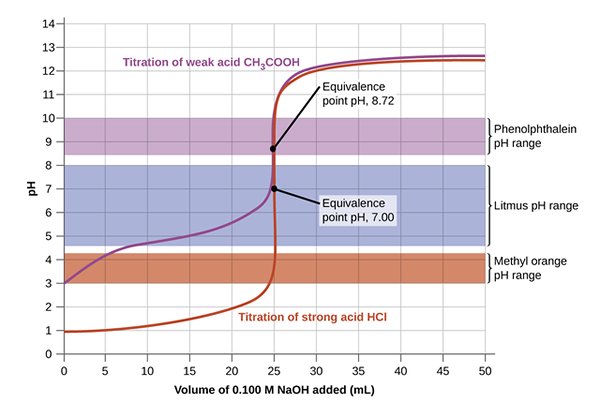
Point d'équivalence dans les signaux de titrage acide-base de la base de la réaction où le nombre de moles du titrant et de l'analyte est égal comme dans l'équation chimique. Par exemple, dans un titrage de NaOH et HCl, 1 mole de HCl sera égal à exactement 1 mole de NaOH au point d'équivalence. Ce point doit être atteint avec précision en administrant un certain nombre de gouttes de la solution standard à la concentration inconnue. Une pipette est généralement utilisée pour verser des gouttes du titrant dans le ballon de mesure où l'analyte a été versé avec un certain indicateur. Les indicateurs sont importants dans les titrages acidaux pour voir clairement l'équivalence et les points de terminaison.
Le titrage acide et de base peut se produire entre une base forte et une base faible; base forte et acide faible; base forte et base forte; ou acides polyprotiques faibles. Un indicateur différent peut être utilisé en fonction de la solution typique utilisée pour le titrage. Par exemple, dans un titrage NaOH et HCL, une phénolphtaleine est utilisée, alors que dans le NH3 et HCL Un indicateur de méthyl orange est plus adapté pour effectuer des changements. Si le pH du titrant correspond au pH au point d'équivalence, le point final et le point d'équivalence peuvent se produire simultanément.
L'image ci-dessous donne une compréhension claire de la configuration du titration afin d'atteindre le point d'équivalence, puis d'atteindre plus tard le point final lorsque la couleur change. Au début, la solution avec la concentration inconnue est versée avec l'indicateur. Ensuite, le titrant est ajouté en utilisant la bureautte en contrôlant les gouttes avec la vanne. L'équation macideVacide = MbaseVbase est utilisé pour calculer la concentration inconnue par des manipulations algébriques notant que la molarité est un certain nombre de moles par litre.
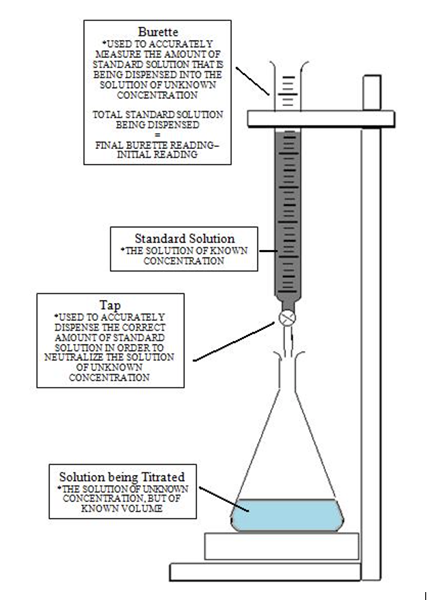
Définition du point de terminaison
Le point de terminaison vient après le point d'équivalence des titrages. Il indique que le point d'équivalence a été atteint. Ce point de terminaison est indiqué par le changement de couleur de la solution. Voir l'image ci-dessous:

Image gracieuseté: Chemistry LibreTexts
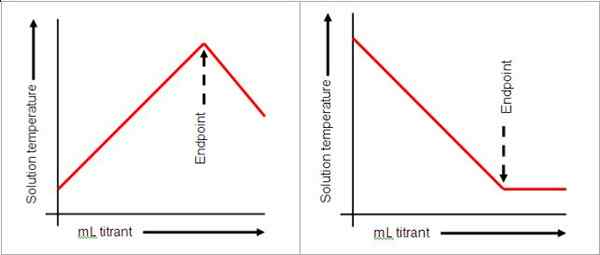
Pour atteindre le point final, la quantité de gouttes doit être administrée avec soin car une seule goutte peut modifier le pH de la solution. Dans la situation où le point final a été passé, un titrage arrière ou un titrage inversé peut être effectué en fonction de la nature de la solution. Si trop de titrant a été versé, le point final pourrait être passé. La solution sera d'ajouter une autre solution d'un réactif différent en excès.
Les indicateurs ne sont pas toujours utilisés dans les titrages. Les pH-mètres peuvent être utilisés pour lire le pH comme une indication que la réaction est complète. Dans une base forte et acide, un pH de 7 indique que la réaction est complète. Le changement de couleur est cependant un moyen pratique de surveiller le point final, donc les indicateurs sont souvent utilisés. Une solution de chlorure de sodium et d'acide chlorhydrique atteint le point de terminaison comme indiqué par la phénolphtaléine lorsque la solution devient rose. Le point final n'indique pas nécessairement la fin de la réaction, mais l'achèvement du titrage.
Différence entre le point de terminaison et l'équivalence
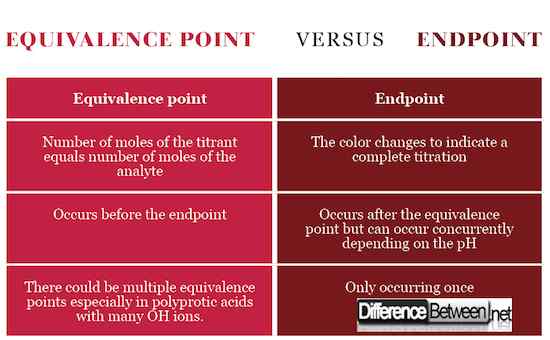
Définition du point final et de l'équivalence
Le point de terminaison est l'étape de titration qui est indiquée par un changement de couleur comme un signe que le titrage est terminé et le point d'équivalence a été atteint. Le point d'équivalence, en revanche, est la scène juste avant le point final qui signale le point stoechiométrique avec un nombre égal de moles entre l'analyte et le titrant en ligne avec l'équation chimique. Pour atteindre le point d'équivalence, le titrant doit être versé avec précision et précisément en baisse à l'aide de la bureautte.
Occurrence de point final et d'équivalence
Le point d'équivalence se produit lorsque le nombre de moles du titrant, la solution standard, est égal au nombre de moles de l'analyte, la solution avec une concentration inconnue. Le point de terminaison se produit lorsque la couleur change.
Signification du point final et de l'équivalence
Le point d'équivalence signifie que le titrant a entièrement réagi avec l'analyte tandis que le point final signale l'achèvement du titrage. Le point final et l'équivalence peuvent se produire en même temps si le pH du titrant correspond au pH au point d'équivalence.
Équivalence des versets de point de terminaison: graphique de comparaison
Résumé de l'équivalence des versets de point de terminaison
- Le point de terminaison et le point d'équivalence sont les étapes les plus importantes des titrages chimiques
- Le point de terminaison se produit après le point d'équivalence et il indique l'achèvement du titrage, mais pas toujours la fin de la réaction.
- Le point d'équivalence se produit avant le point final et indique la réaction complète entre le titrant et l'analyte où le nombre de moles du titrant est égal au nombre de moles de la concentration inconnue
- Le point de terminaison est atteint lorsque la couleur change si l'indicateur a été utilisé
- D'autres acides faibles peuvent avoir plusieurs points d'équivalence mais un seul point final
- Le point d'équivalence est également appelé point stœchiométrique
- « Différences entre les lettres de rendez-vous et les lettres d'offre
- Différences entre Instagram et Twitter »

