Différence entre les cellules galvaniques et les cellules électrolytiques
- 3462
- 846
- Mathilde Roux
Il existe deux types de cellules électrochimiques: les cellules galvaniques - avec des processus redox spontanés qui permettent un flux continu d'électrons à travers le conducteur, par lequel l'énergie chimique est transformée en une circulation électrique; et électrolytique, où les réactions redox sont influencées par une source externe de courant, où l'électricité est convertie en énergie chimique.

Qu'est-ce que la cellule galvanique?
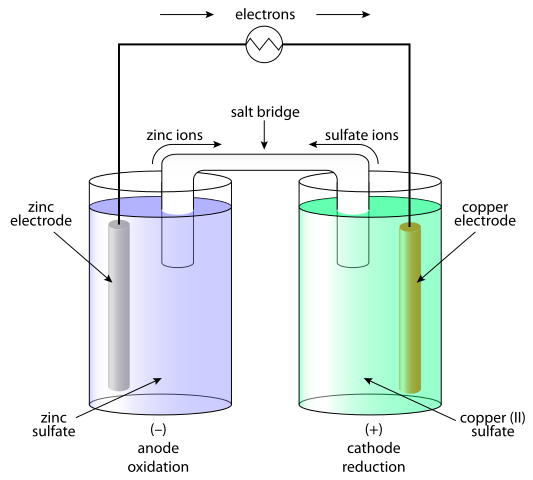
Les cellules galvaniques sont des systèmes dans lesquels l'énergie chimique est transformée en électricité et, par conséquent, le courant est généré. Dans les cellules galvaniques, le courant direct est généré à la suite du processus redox (oxydation-réduction). L'élément galvanique se compose de deux demi-cellules. La demi-cellule est composée de l'électrolyte et de l'électrode immergée dedans. Entre ces demi-cellules, un contact doit être fourni, en reliant l'électrolyte à un pont de sel ou à une membrane semi-conductive et en reliant l'électrode à un conducteur. La séparation du processus redox s'explique par le comportement des électrodes par rapport à l'électrolyte. L'option la plus simple est que la demi-cellule est formée d'une électrode métallique immergée dans un correspondant en ions contenant des électrolytes avec l'électrode. Le comportement des métaux dans l'électrolyte dépend de la réactivité du métal I.e. sa tendance à se dissoudre.
Qu'est-ce que la cellule électrolytique?
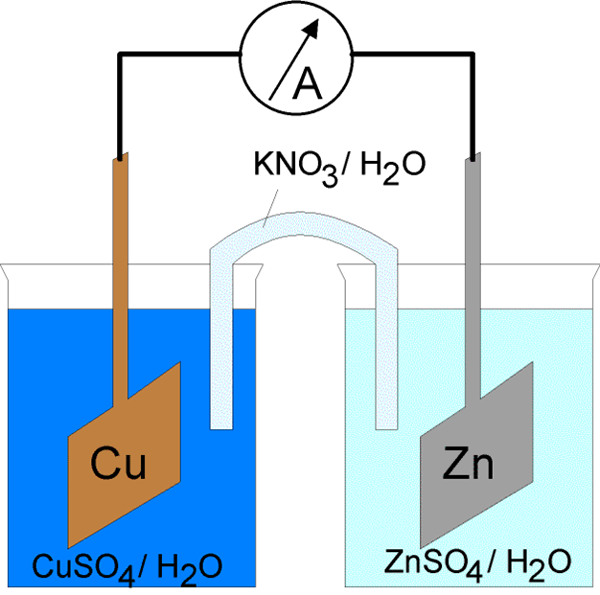
Le courant électrique à travers la cellule électrochimique peut être initié de deux manières. La première consiste à connecter des électrodes à un conducteur dans un circuit électrique fermé. En fermant le circuit électrique, il est possible d'induire spontanément des réactions d'électrode sur les deux phases du métal / électrolyte. De plus, l'énergie du courant est libérée au détriment de l'énergie d'une réaction chimique spontanée. Une cellule qui fonctionne de cette façon est appelée une cellule galvanique. Cela a été expliqué ci-dessus. Une autre façon consiste à fermer le circuit électrique par liaison série d'une source externe de courant par opposition à la tension de la cellule, dans laquelle la tension externe est supérieure à la force électromotive de la cellule. Il entraîne le courant dans la direction opposée de la direction de son flux spontané à travers la cellule. Pour cette raison, les réactions des électrodes dans la cellule doivent être contraires à la direction de leur flux spontané. Les processus forcés dans une cellule électrochimique sous l'influence d'une source externe de courant électrique sont appelés électrolyse, et la cellule électrochimique dans un tel mode de fonctionnement est appelée cellule électrolytique.
Différence entre les cellules galvaniques et électrolytiques
-
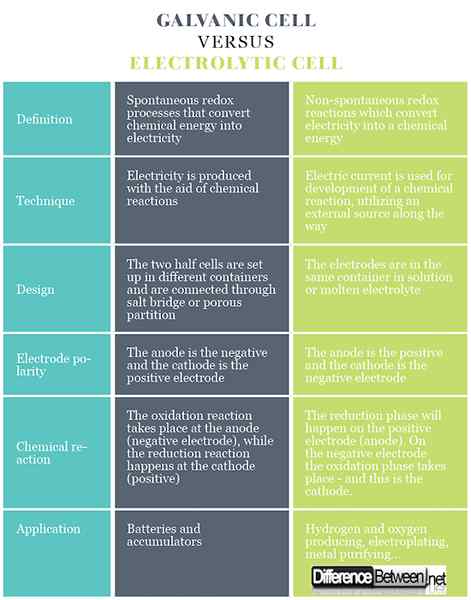
Définition des cellules galvaniques et électrolytiques
Dans les cellules galvaniques, il existe des processus redox spontanés qui permettent un débit continu d'électrons à travers le conducteur, par lequel l'énergie chimique est convertie en électrique. Dans une cellule électrolytique, les réactions redox ont lieu sous l'influence d'une source externe, où l'électricité est convertie en une énergie chimique. Les réactions redox sont non spontanées.
-
Technique de cellules galvaniques et électrolytiques
Les cellules galvaniques génèrent de l'électricité à l'aide de réactions chimiques. Dans les cellules électrolytiques, un courant électrique est utilisé pour le développement d'une réaction chimique, en utilisant une source externe en cours de route.
-
Conception de cellules galvaniques et électrolytiques
Les cellules galvaniques se compose de deux électrodes différentes immergées dans des solutions de leurs ions séparées par une membrane semi-perméable ou un pont de sel. Les cellules électrolytiques se composent d'un récipient électrolytique dans lequel deux électrodes sont connectées à une source CC. L'électrolyte peut être une fusion ou une solution aqueuse de sel, d'acide ou d'alcali.
-
Polarité des électrodes dans les cellules galvaniques et électrolytiques
Dans les cellules galvaniques, l'anode est négative et la cathode est l'électrode positive. Dans les cellules électrolytiques, l'inverse se produit.
-
Réaction chimique dans les cellules galvaniques et électrolytiques
En cas de cellule galvanique, la réaction d'oxydation a lieu à l'anode (électrode négative) où il y a un excédent de charge négative. À la cathode, la réaction de réduction se produit, induisant une accumulation positive de charge. En cas de cellule électrolytique, une source extérieure est utilisée pour déclencher une réaction. À l'électrode négative, les électrons en sont poussés - donc la phase de réduction se produira sur l'électrode négative. Sur l'électrode positive, la phase d'oxydation a lieu - et c'est l'anode.
-
Application de cellules galvaniques et électrolytiques
Les cellules galvaniques sont utilisées comme source de courant électrique et sont plus souvent appelées batteries ou accumulateurs. Les cellules électrolytiques ont des utilisations pratiques différentes, certaines d'entre elles fabriquant de l'hydrogène et de l'oxygène gazeux pour des applications commerciales et industrielles, électroplate, extraction des métaux purs des alliages et ainsi de suite.
Galvanic vs. Cellule électrolytique: comparaison sous forme tabulaire
Résumé de Galvanic vs. Cellule électrolytique
- Une cellule électrochimique est composée de deux demi-cellules ou électrodes dont le contact est établi via un électrolyte (conducteur ionique). Les demi-cellules, si elles sont séparées, peuvent être rejointes par un pont de sel (solution concentrée d'électrolytes dans le gel d'agar-agar)). La cellule galvanique produit un courant électrique basé sur un changement chimique qui y arrive spontané. La cellule électrolytique fait exactement le contraire: le courant entraîne un changement chimique. Pour que la cellule soit galvanique, un changement chimique spontané doit se produire dedans.

