Différence entre les liaisons hydrogène et les liaisons covalentes
- 5045
- 1563
- Théo Roy

Le sujet montre très clairement que l'article est basé sur certains concepts de la chimie. Pour ceux d'entre vous qui connaissent les concepts de base de la liaison chimique, il est facile de comprendre que la discussion concerne deux types de liaisons. Quant aux autres, disons simplement que parmi les nombreuses liaisons chimiques qui se produisent entre les atomes et les molécules, nous allons discuter et différencier deux types de liaisons très importantes, à savoir les liaisons hydrogène et les liaisons covalentes.
Il est très souvent pour les gens de confondre les deux. Cela est dû à une vague définition proposée pour les expliquer par rapport à d'autres types de liaisons. La définition la plus simple offerte est qu'une liaison entre deux non-métaux est généralement covalente alors qu'une liaison entre un métal et un non-métal est ionique. Ces définitions sont assez généralisées et il y a beaucoup d'exceptions ainsi que des contradictions. Tout d'abord, il faut noter que toutes les obligations entre deux non-métaux ne relèvent pas de la catégorie des obligations covalentes; Il existe également d'autres liaisons, dont une est une liaison hydrogène.
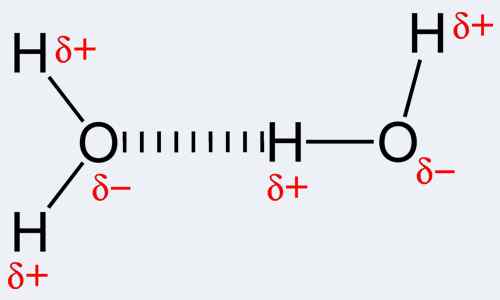
Par définition, une liaison covalente est une forme d'une liaison chimique qui se produit en raison du partage de paires d'électrons entre les mêmes atomes ou distincts. La liaison covalente, à son tour, fait référence à l'équilibre de force stable (attrayant et répulsif) entre les atomes lorsqu'ils partagent des électrons. Le partage permet à chaque atome d'atomes d'atteindre une coquille extérieure qui équivaut à une coquille de valence complète ou une coque extérieure. Cela explique une configuration stable d'électrons. Contrairement à cela, une liaison hydrogène est en fait le nom de l'attraction électrostatique entre des types spéciaux de molécules, appelés molécules polaires. La liaison se produit de manière unique lorsqu'un atome d'hydrogène qui est déjà lié à un atome hautement électronégatif (l'un des trois; oxygène, azote ou fluor) subit une autre force d'attraction d'un atome voisin qui est également hautement électronégatif. Notez que l'hydrogène doit être là pour qu'une liaison hydrogène se produise, et donc le nom de la liaison. De plus, l'un des trois atomes mentionnés ci-dessus doit y être lié. En effet. Cela fait que l'hydrogène se comporte comme une particule chargée positivement car les électrons chargés négativement ont été attirés vers l'azote, le fluor ou l'atome d'oxygène correspondant. Par conséquent, cette particule d'hydrogène, qui est maintenant positive, est facilement attirée vers un autre atome électronégatif en raison de sa négativité. Utiliser le nom Hydrogène Bond pour cette interaction chimique, c'est plus comme utiliser un terme impropre car il n'y a pas de vraie liaison qui est formée. En fait, il y a des attractions di-pole aux pôles.
Les interactions qui se déroulent dans la liaison covalente comprennent la liaison métallique à métal, trois liaisons électroniques au centre, les interactions agostiques, la liaison π et la liaison σ. Il est en effet notable que la covalence est la plus grande entre les atomes qui ont des électronégativités similaires. Cela implique que les deux atomes n'ont pas besoin d'être du même élément mais devraient avoir une électronégativité comparable et proche pour permettre des liaisons plus fortes. Par opposition à cela, les liaisons hydrogène sont intermoléculaires, c'est-à-dire se produisent entre les molécules ou entre différentes parties d'une molécule. Les liaisons hydrogène sont assez fortes; Forces plus fortes que Van der Waals mais sont plus faibles que les liaisons covalentes et ioniques. Des exemples de molécules où se produisent la liaison hydrogène comprend l'eau ainsi que certaines molécules organiques telles que les protéines, l'ADN, etc.
Résumé des différences exprimées dans les points
1. Liaison covalente-une liaison chimique qui se produit en raison du partage de paires d'électrons entre les atomes identiques ou distincts, la liaison covalente se réfère à l'équilibre de force stable (à la fois attrayant et répulsif) entre les atomes lorsqu'ils partagent les électrons, le partage permet à chaque atome d'atteindre d'atteindre une coquille extérieure équivalente à une coque de valence complète ou une coquille extérieure; Une liaison hydrogène est l'attraction électrostatique entre des types spéciaux de molécules, appelés molécules polaires. La liaison se produit de manière unique lorsqu'un atome d'hydrogène déjà lié à un atome hautement électronégatif (l'un des trois; oxygène, azote ou fluor) subit une autre force d'attraction d'un atome voisin qui est également très électronégatif
2. Le liaison covalente peut se produire entre une grande variété d'atomes; Les liaisons hydrogène nécessitent de l'hydrogène et de l'oxygène, de l'azote ou du fluor
3. La liaison covalente est plus forte que les liaisons hydrogène

