Différence entre la liaison ionique et covalente
- 3511
- 130
- Sarah Poirier
 Ionic vs liaison covalente
Ionic vs liaison covalente
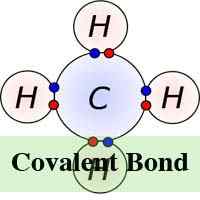
En chimie, une molécule et un composé se forment lorsque deux atomes ou plus se connectent les uns aux autres via un processus chimique connu sous le nom de liaison. Il existe deux types de liaisons chimiques «covalentes et ioniques. Dans la forme ionique de la liaison chimique, les atomes qui sont liés ensemble, le font en attirant des ions qui ont la charge opposée et le nombre d'électrons qui sont échangés dans le processus peuvent varier. Dans la liaison chimique cependant, les atomes partagent des électrons.
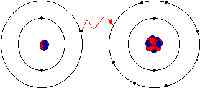
Dans la liaison ionique, les électrons sont totalement transférés de l'un des atomes de liaison à l'autre. Ce sont les forces électrostatiques qui font les ions avec une charge opposée pour s'attirer les uns par les autres. Par exemple, dans une liaison ionique entre le sodium et le chlore, le sodium perd son seul électron qui est chargé positivement à l'ion chargé négativement du chlore. En liaison ionique, l'atome perdant son électron se rétrécit et l'atome gagnant des électrons augmente en taille. Ce n'est pas le cas dans la liaison covalente dans laquelle les ions sont partagés également. La liaison covalente a lieu lorsque les atomes se produisent parce que les atomes du composé ont une capacité similaire à gagner et à perdre des ions. Ainsi, les liaisons ioniques peuvent se former entre les métaux et les non-métaux tandis que les liaisons covalentes se forment entre deux non-métaux.
 Les liaisons ioniques peuvent également être dissoutes dans l'eau et d'autres types de solvants polaires. De plus, les composés ioniques sont de très bons conducteurs d'électricité. Les liaisons ioniques conduisent également à la formation de solides cristallins avec une température de fusion élevée. Les composés ioniques sont également toujours solides.
Les liaisons ioniques peuvent également être dissoutes dans l'eau et d'autres types de solvants polaires. De plus, les composés ioniques sont de très bons conducteurs d'électricité. Les liaisons ioniques conduisent également à la formation de solides cristallins avec une température de fusion élevée. Les composés ioniques sont également toujours solides.
Pendant ce temps, contrairement à la liaison ionique, la liaison covalente nécessite que les molécules existent sous leur forme vraie et, par conséquent, les molécules covalentes ne sont pas attirées les unes contre les autres mais existent librement dans les liquides ou les gaz à température ambiante. La liaison covalente peut également entraîner une liaison multiple contrairement à la liaison ionique. En effet.

