Différence entre lyophilique et lyophobe.
- 1053
- 256
- Théo Roy

Lyophilique et lyophobe sont des termes utilisés pour décrire les solvants et comment ils réagissent à l'eau lorsqu'ils sont mélangés. Le terme «lyo» signifie «solvant» et «philique» signifie «attirer». Lyophobe peut également être divisé en deux termes - «Lyo» et «Phobie» où «Phobique» signifie «haïr». Ainsi, les substances lyophiles sont celles qui attirent le solvant et se mélangent facilement avec elle pour former un mélange uniforme tandis que le lyophobe signifie un solvant qui n'est pas mignais avec l'eau et aura tendance à se séparer.
Définition:
Les solvants lyophiliques signifient des colloïdes ou des solvants aimant les liquides qui se mélangent complètement dans l'eau tandis que les solvants lyophobes signifient des solvants haineux de liquide qui détestent l'eau et ne s'y dissolvent donc pas facilement.
Propriétés:
La raison pour laquelle certains solvants sont lyophiliques et d'autres lyophobes sont dus aux charges présentes sur les molécules qui conduisent à l'attraction ou à la répulsion avec les molécules d'eau / solvant. Lorsqu'il y a une attraction entre les molécules, elles mélangent et forment facilement une solution uniforme tandis qu'en cas de répulsion, les deux substances se séparent à des entités distinctes.
Préparation:
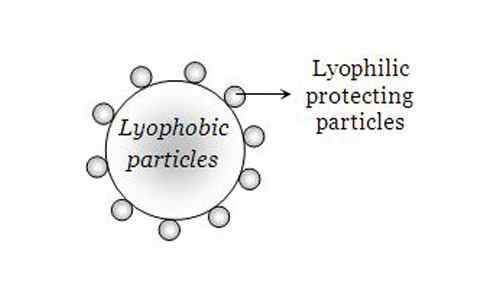
Une solution lyophile est très facile à préparer car le soluté se dissout facilement dans l'eau et n'a pas besoin de stabilisateur supplémentaire. Les solvants lyophobes sont relativement difficiles à préparer car ces solvants détestent l'eau; Ainsi, différentes techniques doivent être appliquées pour créer un mélange complet. Ils ont également besoin de stabilisateurs supplémentaires afin que le solvant lyophobe reste dans cet état.
La stabilité:
Les solvants lyophiles sont naturellement stables car il existe de fortes forces attractives parmi les molécules qui les maintiennent fermement avec l'eau. Les solvants lyophobes sont relativement moins stables car il y a moins de force d'attraction entre les molécules. On dit que les forces intermoléculaires de l'attraction sont très faibles dans les solvants lyophobes nécessitant des agents supplémentaires comme des stabilisateurs pour les maintenir dans l'état dissous dans l'eau.
Charge
La charge sur les solvants lyophiliques dépendra du pH de la solution et peut donc être positif, négatif ou neutre tandis que la charge sur le solvant lyophobe peut être positive ou négative.
Réversibilité
Les solvants lyophiles sont de nature réversible car sur l'évaporation de l'eau, il y aura la formation d'un résidu qui peut à nouveau se transformer à l'état colloïdal sur l'ajout d'eau. En revanche, il s'agit d'une réaction irréversible en cas de solvants lypohobiques, comme une fois que l'eau est évaporée; Le résidu laissé derrière ne peut pas être converti en solution en ajoutant de l'eau.
Électrophorèse
Selon la charge, les molécules lyophiles peuvent migrer vers la cathode, l'anode ou non du tout bouger du tout. En cas de solvants lyophobes, les molécules lorsqu'elles sont exposées à l'électrophorèse, ne se déplaceront que vers la cathode ou l'anode.
Solubilité:
Les solvants lyophiles ne sont pas facilement précipités ou coagulés car ils sont très stables dans leur état. Les solvants lyophobes sont facilement précipités ou coagulés sur l'ajout de certains électrolytes appropriés. Les solvants lyophobes ne sont pas très stables et peuvent donc être facilement décomposés.
Nature de la substance:
Les solvants lyophiles sont généralement formés par des substances organiques comme l'amidon, la gomme, les protéines, etc. Les solvants lyophobes sont généralement formés par des matériaux inorganiques comme les métaux, leurs sulfures, etc.
Visibilité:
Les particules de solvants lyophiles sont facilement dissous et non visibles alors que les particules des solvants lyophobes ne sont pas visibles facilement mais peuvent être détectées à l'aide de microscope.
Hydratation:
Les solvants lyophiles sont hydratés et ont des niveaux d'eau très élevés alors que les solvants lyophobes ne sont pas facilement hydratés.
Résumé:
Les lyophiliques sont des solvants aimant l'eau tandis que les solvants lyophobes sont des solvants qui détestent l'eau et ne sont pas facilement miscibles avec l'eau. Les solvants lyophiliques se mélangent facilement avec de l'eau sans aucun traitement tandis que les solvants lyophobes ont besoin de produits chimiques spéciaux appelés stabilisateurs pour les rendre miscibles avec de l'eau.
- « Différence entre l'hyoscine et l'hyoscyamine.
- Différence entre le myélome et le myélome multiple »

