Différence entre masse molaire et masse moléculaire
- 1392
- 129
- Adrien Jean
Les chimistes mesurent fréquemment les substances en utilisant la masse molaire et la masse moléculaire. Un exemple serait de déterminer le nombre de molécules dans un cylindre. La chimie étudie l'interaction des atomes et des molécules à l'échelle atomique.

Qu'est-ce qu'une masse moléculaire?
Premièrement, la molécule fait référence à la composition d'atomes similaires ou différents disposés dans des rapports. Les molécules peuvent former des composés chimiques soumis aux propriétés physiques et chimiques de chaque molécule.
En un mot, une masse moléculaire se réfère à la masse totale d'une substance. Il résume les masses moyennes d'atomes individuels dans une molécule de cette substance particulière.
Afin de déterminer la masse moléculaire d'un composé X, vous devez ajouter les masses atomiques de tous les éléments de la composition, y compris leurs multiplications conformément aux indices de la formule.
Nous illustrerons avec un exemple ci-dessous. Ces masses atomiques sont tirées directement du tableau des éléments périodiques. Ils sont mesurés en unités de masse atomique (AMU), tout comme la masse moléculaire.
Exemple 1:
Déterminer la masse moléculaire de H2O et CH3CH2OH.
Répondre:
Vous devez évaluer les compositions des formules moléculaires données et dériver leurs masses atomiques du tableau périodique. Tenez compte des indices.
Par exemple, H2O indique qu'il y a deux atomes d'hydrogène et un atome d'oxygène. La masse atomique de l'hydrogène est, à partir du tableau périodique, 1.0079 AMU et celui de l'oxygène est de 15.9994. La masse moléculaire du composé est 2 (1.0079) + 15.9994 = 18.0152 AMU.
Et pour déterminer la masse moléculaire de l'éthanol, l'autre formule donnée dans la question, nous suivons les mêmes étapes. Il y a 2 atomes de carbone, 6 atomes d'hydrogène et 1 atome d'oxygène. La masse atomique de l'atome de carbone est de 12.011 AMU. Cela dit, la masse moléculaire de CH3CH2OH est 2 (12.011) + 6 (1.0079) + 1 (15.9994) = 46.069 AMU. Pour votre exercice, calculez la formule moléculaire de l'éthane (C2H4) et du CO2.
Qu'est-ce que la masse molaire?
Maintenant, en ce qui concerne le concept de masse molaire, il est défini comme la masse en kilogrammes ou grammes d'une taupe de substance. Habituellement, les unités de masse molaire sont grammes / mol. Une taupe d'un élément d'oxygène a une masse de 15.9994 grammes. Ainsi, la masse molaire serait de 15.9994 g / mol. Pour un composé de dioxyde de carbone, par exemple, la masse molaire est définie comme la masse de 1 mole de molécules dans ce composé. Numéro d'Avogadro, 6.022 x 1023 est souvent utilisé pour relier le nombre d'atomes, de molécules et d'autres unités à laquelle une masse molaire est égale à. Par exemple, une masse molaire de H2O serait égale à la masse en grammes par mole de 6.022 x 1023 molécules d'eau. Si cela semble trop technique, nous illustrons avec un exemple ci-dessous:
Exemple 2:
Déterminer la masse molaire de l'éthanol.
Répondre:
Dans le premier exemple, nous avons déterminé la masse moléculaire de l'éthanol (C2H5OH). Ne soyez pas confus par une formule différente comme le. Nous venons de jouer avec les arrangements structurels de la formule d'éthanol bien que le rapport des atomes reste le même.
L'éthanol contient 6.022 x 1023Molecules, et la masse molaire est égale à la masse d'éthanol qui contient ces molécules. Nous avons trouvé que la masse moléculaire de l'éthanol était 46.069 Unités de masse atomique dans notre exemple précédent. La même procédure est suivie dans le calcul de la masse molaire.
Une mole d'éthanol a 2 atomes de carbone de mole, 6 moles d'atomes d'hydrogène et une mole d'atome d'oxygène. Prenant les masses atomiques du tableau d'époque, nous constatons que la masse molaire est de 2 (12.011g) + 6 (1.0079g) + 15.9994G qui est égal à 46.069 g / mois. Remarquez la même valeur mais différentes unités.
NB: La masse molaire de toute substance chimique se réfère à sa masse atomique ou à la masse moléculaire en grammes par taupe. Les valeurs sont les mêmes unités mais différentes.
Exercice 2:
Calculez la masse molaire du phosphate de calcium (CA3 (PO4) 2). La réponse doit être 310.177 g / mol.
En ce qui concerne le carbone, la masse molaire d'un carbone naturel est différente de celle dérivée du tableau d'époque qui appartient à l'isotope du carbone-12. Naturellement, le carbone contient du carbone-12, du carbone-13 et du carbone 14. Mais une taupe de carbone contient toujours 6.022 x 1023 mais avec différents rapports de ces isotopes.
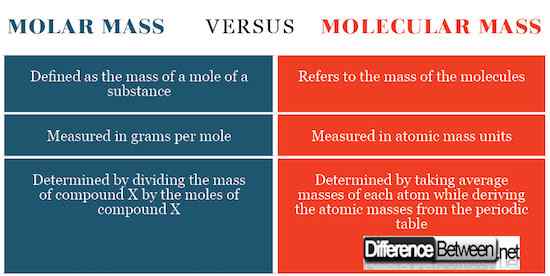
Différences entre la masse molaire et la masse moléculaire
Calcul de la masse molaire et de la masse moléculaire
La masse molaire est déterminée en divisant la masse totale de la substance qui est les masses moyennes de chaque atome par la quantité de moles. Le chiffre résultant sera des grammes par taupe ou des kilogrammes par mole. La masse moléculaire est déterminée en calculant la masse de la substance liée au 1 / 12e des isotopes en carbone-12.
Définition de la masse molaire et de la masse moléculaire
La masse moléculaire se réfère à la masse des molécules tandis que la masse molaire se réfère à la masse d'une taupe d'une substance.
Unités SI pour masse molaire et masse moléculaire
La masse molaire est exprimée en grammes par mole alors qu'une masse moléculaire est exprimée en unités de masse atomique. Cette expression des unités SI remonte à la définition de ces concepts.
Résumé de la masse molaire vs. Masse moléculaire
- La masse molaire et la masse moléculaire sont des concepts importants en chimie
- La masse molaire est exprimée en grammes par mole ou kilogrammes par mole tandis que la masse moléculaire est exprimée en unités de masse atomique. La masse molaire est fondamentalement sans unité.
- Nous calculons la masse molaire en divisant la masse de la substance par la quantité et calculons la masse moléculaire en prenant la masse moyenne des unités de la substance
- Ils ont les mêmes valeurs mais différentes unités SI.
- « Différence entre un livre de passeport et une carte de passeport
- Différence entre explicite et implicite »

