Différence entre la molarité et la molité
- 3096
- 395
- Hugo Marie
Qu'est-ce que la molarité?
La molarité peut être définie comme le nombre de moles d'une substance (connue sous le nom de soluté) qui est dissoute avec précisément 1 litre d'une solution (solvant et soluté combinés).
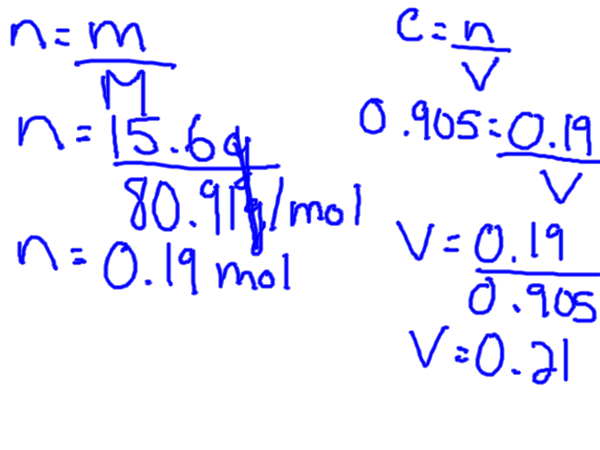
La formule de calcul de la molarité est donc la suivante:
M = solution de soluté mole / L
La molarité est également communément appelée concentration molaire. Donc une mesure de la concentration molaire basée sur le volume de liquide dans lequel une substance est dissoute dans. Il est important de réaliser que le volume est en litres, vous devrez peut-être convertir d'abord si vous avez du volume en ML par exemple.
Pour préparer une concentration molaire, on ajoute une quantité connue de soluté à un ballon volumétrique, puis remplit le ballon de liquide jusqu'à ce que la marque de 1 litre soit atteinte.

Par exemple: on peut constituer une certaine concentration molaire de sucre. Le poids du sucre doit d'abord être converti en moles, puis l'eau est ajoutée jusqu'à ce que 1 litre soit atteint.
Pour calculer la molarité, vous avez besoin du soluté en taupes, mais généralement vous aurez un certain poids de soluté, ce qui signifie que vous devez d'abord convertir les grammes en grammes. Cela peut être fait en trouvant la masse molaire du soluté du tableau périodique.
La formule de concentration molaire peut être réorganisée pour résoudre à la fois le volume et les moles.
Le volume est influencé par les changements de température ou de pression. Par exemple, le volume augmenterait avec l'augmentation de la température. Cela signifie qu'il y aura une question de précision en cas de changements de température.
Si la température diminue suffisamment, le liquide peut se contracter, provoquant une augmentation de la molarité parce que le même nombre de moles demeure mais il y aurait moins de solution.
Inversement, si la température augmente suffisamment, le liquide peut se développer provoquant la diminution de la molarité parce que le même nombre de moles de moles demeure mais il y aurait plus de solution présente.
La molarité peut être utilisée pour calculer la concentration d'une substance diluée.
La molarité peut être utilisée lorsque la précision exacte n'est pas requise. Il est cependant influencé par des changements de température car il s'agit d'une mesure volumétrique, donc dans certains cas, il peut ne pas être approprié pour utiliser.
La molarité et la molialité peuvent être les mêmes dans certains cas. Par exemple, 1 litre d'eau pèse 1 kg.
Qu'est-ce que la molalité?
La molité peut être définie comme le nombre de moles de substance (connue sous le nom de soluté) qui se trouve dans une certaine masse de solvant donnée en kg, qu'elle est dissoute dans.
La formule pour calculer la molité est :
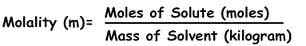
m = soluté mole / kg de solvant
La molialité est également appelée concentration molale.
Un exemple de fabrication d'une concentration molale serait de pondérer une certaine quantité de sucre par exemple. Cela doit ensuite être converti en nombre de moles en utilisant la masse moléculaire du sucre. Un bécher d'eau est ensuite pesé et de l'eau ajoutée au bécher jusqu'à ce qu'elle pèse 1 kg.
Le sucre est ensuite ajouté au bécher de l'eau et dissous.
L'avantage de la molalité sur la molarité est qu'il n'est pas affecté par les changements de température et de pression car il est calculé sur la base de la masse et non du volume. La masse du solvant n'est pas affectée par la température de la manière dont le volume d'une substance est, donc la molalité est une mesure plus précise de la concentration que la molarité.
Dans le cas de l'eau, la molarité et la molalité peuvent être les mêmes puisque 1 litre d'eau pèse 1 kg, mais cela peut ne pas être le cas avec tous les liquides.
Cela signifie que la molalité doit être utilisée lorsque les propriétés colligatives sont concernées.
La molalité est plus précise et fournit une plus grande précision de concentration mais prend plus de temps à se préparer car le soluté doit être ajouté au poids d'un solvant. Si le solvant est liquide, cela doit être pesé.
Cela peut être fait en utilisant un système gravimétrique et un équilibre analytique pour peser le solvant.
Quelle est la différence entre la molarité et la molalité?
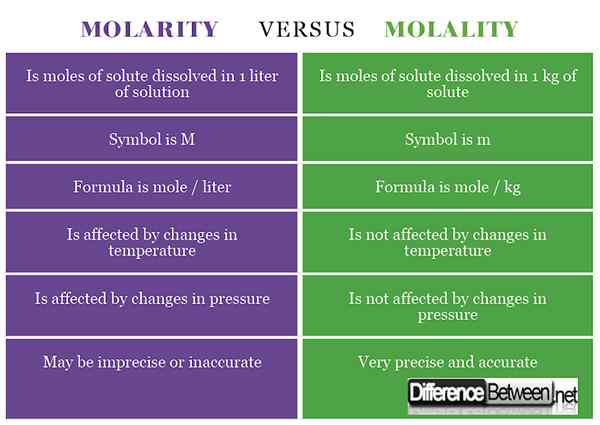
1) La molarité est la concentration d'une substance qui est calculée comme le nombre de moles de soluté qui est dissous dans 1 litre de solution tandis que la molalité est la concentration d'une substance calculée comme le nombre de moles de soluté trouvé dans 1 kg de solvant.
2) Le symbole de la molarité est m, tandis que celle de la molalité est m (parfois écrite comme -m ou m pour le distinguer de la masse).
3) La formule de la molarité est de moles / litre tandis que la formule de la molité est de moles / kg.
4) La molarité est affectée par les changements de température tandis que la molalité n'est pas affectée par les changements de température.
5) La molarité est affectée par les changements de pression tandis que la molalité n'est pas affectée par les changements de pression.
6) La molarité peut entraîner une concentration imprécise et inexacte, tandis que la molalité se traduit par une mesure précise précise de la concentration.
Tableau comparant la molarité et la molalité
Résumé de la molarité et de la molialité
- La molarité et la molialité peuvent toutes deux être utilisées pour mesurer la concentration.
- La molarité est définie comme le nombre de moles de soluté qui sont dissous dans 1 litre d'une solution.
- La molialité est définie comme le nombre de moles d'un soluté qui sont dissous dans 1 kg de solvant.
- Molality est un moyen plus précis et précis de faire une certaine concentration car il n'est pas affecté par la température et les changements de pression.
- La molarité implique un liquide qui signifie que la concentration peut changer. En effet, le volume étant un liquide peut changer avec des changements de température et de pression.
- « Différence entre la déficience intellectuelle et l'invalidité du développement
- Différence entre Groupby et Orderby »

