Différence entre le nitrate et le nitrite
- 1191
- 83
- Elisa Petit

Qu'est-ce que le nitrate?
L'ion nitrate (non3) est une base conjuguée de l'acide nitrique. Il se compose d'un azote et de trois atomes d'oxygène. L'atome d'azote est situé au centre et entouré d'atomes d'oxygène, qui sont à l'identité de liaison dans une conformation trigonale plane. La masse molaire de l'anion nitrate est de 62 g / mol. Il se dissocie dans l'eau pour donner des ions hydroxyles de nitrate.
Les nitrates sont des composés chimiques, des sels de l'acide nitrique. Ils sont facilement solubles. Les nitrates sont utilisés dans:
- Agriculture (engrais minéraux);
- Industrie alimentaire (colorants et conservateurs);
- Production de peintures, médicaments, plastiques, verre, explosifs, etc.
Les nitrates se trouvent dans le sol, l'eau et la nourriture (d'origine végétale et animale). À de faibles concentrations (1 à 40 mg / m3) Ils sont également présents dans l'air comme. Les nitrates sont naturellement synthétisés par des bactéries azotées comme étape intermédiaire dans la formation d'azote. Les concentrations naturelles dans les plantes et l'eau sont généralement faibles. Leur quantité dans des terres arables et dans l'eau ne dépasse normalement pas 10 mg / L. Il peut être augmenté par l'utilisation d'engrais azotés, l'introduction du fumier de bétail et d'autres sources dans le sol.
La teneur en nitrate des plantes varie, selon leur quantité dans le sol. De la solution du sol, les plantes extraient de l'azote, des acides aminés, des protéines, des vitamines et d'autres substances, principalement sous forme de nitrates. Si la plante extrait plus de nitrates que l'enzyme nitrate réductase peut traiter, ils s'accumulent dedans. L'activité de la nitrate réductase dépend de facteurs tels que la lumière, la température et le stress hydrique.
Les nitrates eux-mêmes ne sont pas toxiques. Les nitrites et les nitrosamines sont dangereuses pour la santé humaine. Les deux peuvent se former à partir des nitrates avant ou après l'ingestion de nourriture ou d'eau.
Les nitrates entrent dans le corps humain via la nourriture et l'eau potable. Les aliments riches en nitrates sont les légumes et les produits de viande (saucisses, viandes fumées). Il est beaucoup moins négligeable est la teneur en nitrate dans les produits laitiers et les poissons. Certaines plantes ont la capacité d'accumuler plus de nitrates. Ce sont de la laitue, des carottes, des épinards, de l'aneth, des betteraves rouges, du radis rouge, des courgettes, du brocoli, etc.
Les nitrates dans l'air peuvent agir comme irritants respiratoires. Des études ont montré une augmentation des attaques asthmatiques associées à une augmentation de la teneur en nitrate dans l'air.
La dose maximale autorisée de 24 heures de potassium et de nitrate de sodium pour l'homme est jusqu'à 5 mg / kg. L'empoisonnement se produit à une dose de 4 g / 24h, la dose mortelle humaine est de 8 à 15 g / 24h.
Qu'est-ce que le nitrite?
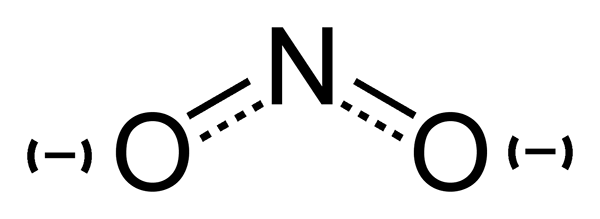
L'ion nitrite (non2) est une base conjuguée de l'acide nitreux. L'anion est symétrique. L'atome d'azote est situé au centre et entouré de deux atomes d'oxygène, qui sont à liaison identique. La masse molaire de l'anion nitrite est de 46 g / mol.
Les nitrites sont des composés chimiques, des sels ou des esters de l'acide nitreux. Ils sont largement utilisés dans la production de produits de viande et de poisson. Ils ont une action bactéricide. Leur réaction avec la myoglobine donne à la viande un aspect frais et une couleur rouge rose.
Les humains peuvent être exposés aux nitrates de plusieurs manières. La fécondation excessive de l'azote augmente la teneur en nitrate dans les plantes et respectivement chez l'homme (via les aliments). Dans le corps humain, les nitrates sont réduits en nitrites. Les plantes supérieures peuvent également assimiler le nitrite du sol. La conversion microbiologique des nitrates en nitrites peut se produire lorsque les légumes frais sont stockés, en particulier à température ambiante.
Les nitrates, lorsqu'ils sont ingérés, sont classés comme «probablement cancérigènes aux humains». Ils se lient à l'hémoglobine dans le sang et forment un composé appelé méthémoglobine. Il est incapable de transporter de l'oxygène aux organes et aux tissus, ce qui conduit à une condition connue sous le nom de méthémoglobinémie, caractérisée par des ecchymoses de la peau et des muqueuses (cyanose) (cyanose).
Les nitrates sont les plus dangereux lorsqu'ils sont convertis en nitrite avant d'être avalés. Cette conversion peut se produire lorsque les aliments sont stockés mal (haute température et réduction de la teneur en oxygène dans la pièce) ou pendant la cuisson, en particulier pendant la friture.
Les nitrites endommagent directement les structures cellulaires de différents organes et systèmes, selon la dose. Ils perturbent le transport de l'oxygène, causent des dommages toxiques aux systèmes enzymatiques, provoquent des changements mutagènes, cancérigènes et d'autres changements subcellulaires, réduisent l'activité du système immunitaire.
Dans une faible acidité de l'acide gastrique, les nitrites peuvent être convertis en nitrosamines, qui ont un effet cancérigène.
La dose maximale admissible de nitrite pendant 24 heures est 0.2 mg / kg. La dose mortelle humaine est 0.18-2.5 g / 24 h. On pense que prendre 0.5 g de nitrite peuvent entraîner une légère et 1 à 2 g - à une empoisonnement sévère.
Différence entre le nitrate et le nitrite
-
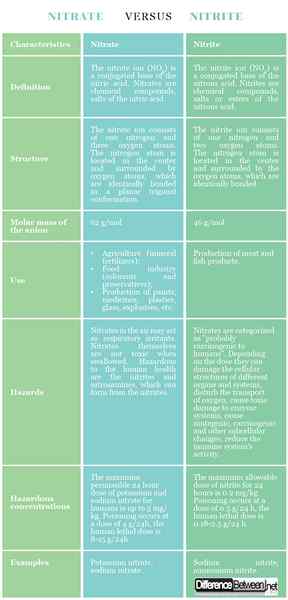
Définition
Nitrate: L'ion nitrate (non3) est une base conjuguée de l'acide nitrique. Les nitrates sont des composés chimiques, des sels de l'acide nitrique.
Nitrite: L'ion nitrite (non2) est une base conjuguée de l'acide nitreux. Les nitrites sont des composés chimiques, des sels ou des esters de l'acide nitreux.
-
Structure
Nitrate: L'ion nitrate se compose d'un azote et de trois atomes d'oxygène. L'atome d'azote est situé au centre et entouré d'atomes d'oxygène, qui sont à l'identité de liaison dans une conformation trigonale plane.
Nitrite: L'ion nitrite se compose d'un azote et de deux atomes d'oxygène. L'atome d'azote est situé au centre et entouré par les atomes d'oxygène, qui sont à liaison identique.
-
Masse molaire
Nitrate: La masse molaire de l'anion nitrate est de 62 g / mol.
Nitrite: La masse molaire de l'anion nitrite est de 46 g / mol.
-
Utiliser
Nitrate: Les nitrates sont utilisés dans l'agriculture (engrais minéraux), l'industrie alimentaire (colorants et conservateurs), la production de peintures, de médicaments, de plastiques, de verre, d'explosifs, etc.
Nitrite: Les nitrites sont utilisés dans la production de viande et de produits de poisson.
-
Dangers
Nitrate: Les nitrates dans l'air peuvent agir comme irritants respiratoires. Les nitrates eux-mêmes ne sont pas toxiques lorsqu'ils sont avalés. Les nitrites et les nitrosamines, qui peuvent se former à partir des nitrates.
Nitrite: Les nitrates sont classés comme «probablement cancérigènes à l'homme». Selon la dose, ils peuvent endommager les structures cellulaires de différents organes et systèmes, perturber le transport de l'oxygène, causer des dommages toxiques aux systèmes enzymatiques, provoquer des changements mutagènes, cancérigènes et autres changements subcellulaires, réduisent l'activité du système immunitaire.
-
Concentrations dangereuses
Nitrate: La dose maximale autorisée de 24 heures de potassium et de nitrate de sodium pour l'homme est jusqu'à 5 mg / kg. L'empoisonnement se produit à une dose de 4 g / 24h, la dose mortelle humaine est de 8 à 15 g / 24h.
Nitrite: La dose maximale admissible de nitrite pendant 24 heures est 0.2 mg / kg. L'empoisonnement se produit à une dose de 0.5 g / 24 h, la dose mortelle humaine est 0.18-2.5 g / 24 h.
-
Exemples
Nitrate: Nitrate de potassium, nitrate de sodium.
Nitrite: Nitrite de sodium, nitrite d'ammonium.
Résumé:
- L'ion nitrate (non3) est une base conjuguée de l'acide nitrique. Les nitrates sont des composés chimiques, des sels de l'acide nitrique.
- L'ion nitrite (non2) est une base conjuguée de l'acide nitreux. Les nitrites sont des composés chimiques, des sels ou des esters de l'acide nitreux.
- L'ion nitrate se compose d'un azote et de trois atomes d'oxygène. L'atome d'azote est situé au centre et entouré d'atomes d'oxygène, qui sont à l'identité de liaison dans une conformation trigonale plane. L'ion nitrite se compose d'un azote et de deux atomes d'oxygène. L'atome d'azote est situé au centre et entouré par les atomes d'oxygène, qui sont à liaison identique.
- La masse molaire de l'anion nitrate est de 62 g / mol, tandis que la masse molaire de l'anion nitrite est de 46 g / mol.
- Les nitrates sont utilisés dans l'agriculture, l'industrie alimentaire, la production de peintures, les médicaments, les plastiques, le verre, les explosifs, etc. Les nitrites sont utilisés dans la production de viande et de produits de poisson.
- Les nitrates dans l'air peuvent agir comme irritants respiratoires. Les nitrates eux-mêmes ne sont pas toxiques lorsqu'ils sont avalés. Les nitrites et les nitrosamines, qui peuvent se former à partir des nitrates. Les nitrates sont classés comme «probablement cancérigènes à l'homme». Selon la dose, ils peuvent endommager les structures cellulaires de différents organes et systèmes, perturber le transport de l'oxygène, causer des dommages toxiques aux systèmes enzymatiques, provoquer des changements mutagènes, cancérigènes et autres changements subcellulaires, réduisent l'activité du système immunitaire.
- La dose maximale autorisée de 24 heures de potassium et de nitrate de sodium pour l'homme est jusqu'à 5 mg / kg. L'empoisonnement se produit à une dose de 4 g / 24h, la dose mortelle est de 8 à 15 g / 24h. La dose maximale admissible de nitrite pendant 24 heures est 0.2 mg / kg. L'empoisonnement se produit à une dose de 0.5 g / 24 h, la dose létale est 0.18-2.5 g / 24 h.
- « Différence entre les chrétiens et les musulmans
- Différence entre la température et l'énergie thermique »

