Différence entre la nitrification et la dénitrification
- 3661
- 674
- Sarah Poirier

Nitrification
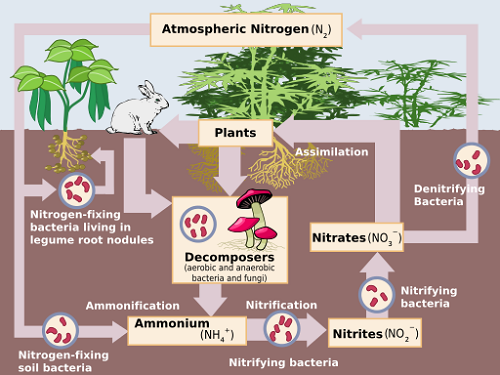
La nitrification est la transformation biologique de l'ammonium (NH4+) au nitrate (non3-) par oxydation. L'oxydation est définie comme la perte d'électrons par un atome ou un composé, ou une augmentation de son état d'oxydation. Le processus est facilité par deux types de bactéries aérobies nitrifiantes qui nécessitent la présence de molécules d'oxygène dissoutes dans leur environnement, pour survivre. [je]
Premièrement, les bactéries chimioautrophiques (principalement celles du genre Nitrosomonas) convertir l'ammoniac (NH3) et l'ammonium en nitrite (non2-). «Chimoautrophic» fait référence à la capacité de la bactérie à créer ses propres nutriments à partir d'une source inorganique, à savoir Co2. Le processus est représenté par l'équation chimique:
2nh4+ + 3o2 → 2No2- + 2h2O + 4H+ + énergie
Puis bactéries principalement à partir du Nitrobacter groupe convertir le nitrite en nitrate dans la réaction suivante:
2No2- + O2 → 2No3- + énergie
Ces réactions ont lieu simultanément et assez rapidement - généralement en quelques jours ou semaines. Il est important que le nitrite soit complètement converti en nitrate dans les sols, car le nitrite est toxique pour la vie végétale.
Les nitrates présents dans le sol sont la principale source d'azote utilisé par les plantes. [ii] Ainsi, la transition de l'azote d'une forme à une autre, connue sous le nom de cycle d'azote, est une partie importante de l'industrie agricole.[iii]
Avant que ces étapes ne se produisent, l'azote organique est décomposé par des bactéries hétérotrophes par hydrolyse pour former l'ammonium et l'ammoniac dans un processus appelé ammonification. je L'ammoniac peut être trouvé dans l'urée à partir de déchets animaux, de composts et de cultures de couverture en décomposition ou de résidus de cultures. L'ammonium se trouve dans la plupart des engrais.
Les bactéries nitrifiantes sont plus sensibles aux stress environnementaux que les autres types de bactéries du sol. Lorsque le sol a été saturé d'humidité pendant des périodes prolongées, les pores du sol se remplissent d'eau, limitant l'oxygène. Les bactéries nitrifiantes nécessitent des conditions aérobies pour fonctionner, donc l'inondation restreint la nitrification.
Les sols secs ont tendance à avoir une concentration élevée de sel et la salinité qui en résulte a un impact négatif sur l'activité nitrifiante de la bactérie. En effet. L'eau est également essentielle pour le mouvement des solutés, comme les nitrates, à travers le sol. ii
Les bactéries nitrifiantes fonctionnent mieux à un pH entre 6.5 et 8.5 et températures entre 16 et 35 degrés C. je Les taux de nitrification sont plus lents dans les sols très acides, tandis que l'alcalinité élevée réduit Nitrobacter activité, provoquant une accumulation défavorable de nitrite dans le sol.
Le pH du sol peut également être affecté par la source particulière d'ammonium nitrifié. Par exemple, la solution de phosphate de monoammonium (MAP) est beaucoup plus acide que le phosphate de diammonium (DAP); L'utilisation de DAP entraîne donc des taux de nitrification plus élevés que la carte.
La majorité des bactéries se trouvent dans la couche de surface supérieure, donc la nitrification diminue lorsque les pratiques du sol ne sont pas gérées correctement.
Les sols à forte teneur en argile ont des particules plus grandes et plus d'espace de micropores pour la croissance bactérienne, ainsi qu'une plus grande rétention d'ammonium en raison d'une capacité d'échange de cations plus élevée. ii Les relations d'eau et les propriétés physiques du sol peuvent être améliorées par une culture réduite.
La nitrification peut être inhibée par la présence de métaux lourds et de composés toxiques, ou des concentrations excessivement élevées d'ammoniac.
Parfois, il peut être avantageux de maintenir l'azote dans le sol sous forme d'ammonium. Cela empêche la perte d'azote (par la lixiviation des nitrates) et l'évasion de l'azote gazeux (par dénitrification). Les inhibiteurs de nitrification utilisés commercialement comprennent le dicyandiamide et la nitrapyrine.
Dénitrification
La dénitrification est la transformation biologique du nitrate en gaz azotés par réduction. Il suit toujours la nitrification je et la séquence de réaction peut être représentée comme suit:
NON3- → Non2- → Non → N2O → N2[iv]
Le processus est facilité par les bactéries facultatives; Ce sont des bactéries qui ne nécessitent pas la présence d'oxygène libre pour la respiration. Les bactéries dénitrifiantes sont des organismes hétérotrophes car ils ont besoin d'une source de nourriture biologique, sous forme de carbone, pour survivre. La dénitrification peut commencer aussi rapidement que quelques minutes après la stimulation du processus.
La dénitrification peut nuire à la production de cultures, puisque l'azote, un nutriment essentiel à la croissance des plantes, est perdu dans l'atmosphère pendant le processus. Cependant, il est bénéfique pour les habitats aquatiques et dans le traitement des eaux usées industrielles ou des eaux usées, car la concentration en nitrate dans l'eau est abaissée. je
La lixiviation ou le ruissellement des cultures dues aux traitements d'engrais peut entraîner des quantités excessives de ce nutriment pour se retrouver dans des plans d'eau, où les composés azotés ont divers effets nocifs sur la vie humaine et aquatique. iv
L'ammoniac est toxique pour les espèces de poissons et stimule la croissance des algues, réduisant les niveaux d'oxygène dans l'eau et entraînant l'eutrophisation. Les nitrates causent des lésions hépatiques, des cancers et une méthémoglobinemie (carence en oxygène chez les nourrissons), tandis que les nitrites réagissent avec les composés organiques appelés amines pour former des nitrosamines cancérigènes. ii
Lorsque les niveaux d'oxygène dans les sols ou l'eau sont épuisés (conditions anoxiques), les bactéries dénitrifiantes décomposent les nitrates pour une utilisation comme source d'oxygène. Cela se produit généralement dans les sols gorgés d'eau où les niveaux d'oxygène sont faibles. Le nitrate est réduit à l'oxyde nitreux (n2O) et encore une fois au gaz azoté. Ces bulles de gaz s'échappent dans l'atmosphère. je
Le gaz formé par les dénitrifiants dépend des conditions du sol ou de l'eau et quel type de communauté microbienne est présente. Moins d'oxygène a tendance à entraîner la formation de plus de gaz d'azote, le produit le plus courant de la dénitrification. L'azote gazeux forme le composant principal de l'air. Le deuxième produit le plus courant formé est l'oxyde nitreux, un gaz à effet de serre qui érode également la couche d'ozone de la Terre. iv
Les bactéries dénitrifiantes sont moins sensibles aux produits chimiques toxiques que les nitrifiants et fonctionnent de manière optimale à un pH entre 7.0 et 8.5 et des températures plus chaudes entre 26 et 38 degrés C. La dénitrification se produit principalement dans la terre végétale, où l'activité microbienne est la plus élevée.
Les dénitrifiants nécessitent une concentration de nitrate suffisante et une source de carbone soluble; Les taux les plus élevés se produisent lors de l'utilisation de méthanol ou d'acide acétique. Le carbone organique peut être trouvé dans le fumier, le compost, les cultures de couverture et les résidus de récolte. je
La minimisation de la dénitrification dans les sols des cultures est obtenue en maintenant la concentration minimale de nitrate nécessaire à la croissance des plantes, comme l'utilisation des engrais à libération contrôlée. Une autre méthode consiste à inhiber la nitrification, ce qui réduit les niveaux de nitrate disponibles pour la dénitrification.
Les niveaux de dénitrification vont largement sur un seul champ, en raison de nombreux facteurs tels que les propriétés du sol (y compris l'agrégation, les macropores et l'humidité) et les variations de l'engrais, de la matière organique et de la distribution des résidus de récolte.
Il a été rapporté que les types d'engrais azotés, ainsi que les méthodes d'application, affectent la dénitrification. Par exemple, les engrais à libération contrôlée revêtus, ainsi que les applications de fertigation et de diffusion, provoquent des émissions d'oxyde nitreuses plus faibles que l'urée granulaire sèche et les applications de bande concentrée. Le placement plus profond de l'azote diminue également ces émissions.
Les périodes sèches suivies d'une tempête de pluie soudaine sont souvent un déclencheur de dénitrification, qui peut être gérée avec des systèmes de drainage et une irrigation à la goutte souterraine. iv
Résumé
Nitrification
- Suit le processus d'ammonification
- Transformation de l'ammonium en nitrate
- Réaction d'oxydation
- Facilité par deux principaux types de bactéries aérobies chimioautrophiques: Nitrosomonas et Nitrobacter
- Processus à deux étapes: conversion de l'ammonium en nitrite, puis conversion du nitrite en nitrate
- Crée une forme nutritive d'azote disponible pour l'absorption par les racines des plantes
- Réactif (ammonium) trouvé dans l'urée à partir de déchets animaux et d'engrais, de composts et de décomposition des cultures de couverture ou des résidus de récolte
- Les nitrifiants plus sensibles aux contraintes environnementales
- Inhibé par des inondations, une salinité élevée, une acidité élevée, une alcalinité élevée, un labour excessif et des composés toxiques
- Favorisé par les conditions aérobies, pH entre 6.5 et 8.5, températures entre 16 et 35 degrés C et une teneur élevée en argile
Dénitrification
- Suit le processus de nitrification
- Transformation du nitrate en gaz azotés, principalement de l'azote et de l'oxyde d'azote
- Réaction de réduction
- Facilité par des bactéries facultatives hétérotrophiques
- Séquence d'étapes: conversion du nitrate en nitrite, en oxyde nitrique, en oxyde nitreux et enfin en azote
- Décontaminer les eaux usées et les systèmes aquatiques en abaissant les niveaux de nitrate
- Réactif (nitrate) formé par la nitrification, tandis que les sources de carbone pour les dénitrifiants se trouvent dans le fumier, couvrent les cultures et les résidus de cultures ou fournies par du méthanol ou de l'acide acétique
- Dénitrifiants moins sensibles aux contraintes environnementales
- Inhibé par une nitrification réduite, une baisse des niveaux de nitrate, un placement profond de l'engrais à libération contrôlée revêtue et du drainage du sol
Favorisé par les inondations, les conditions anoxiques, le pH entre 7.0 et 8.5, températures entre 26 et 38 degrés C, approvisionnement suffisant en nitrates et en carbone soluble et applications de bande concentrée de l'urée granulaire sèche.
- « Différences entre l'énergie du charbon et l'énergie nucléaire
- Différence entre la chaleur spécifique et la capacité de chaleur »

