Différence entre l'oxydation et la combustion
- 2778
- 818
- Adrien Jean
 Oxydation vs combustion
Oxydation vs combustion
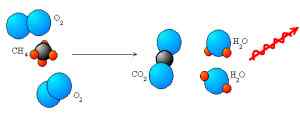
Nous avons entendu parler du processus de combustion et d'oxydation dans notre école. Mais seuls quelques-uns connaissent les principales différences entre elles. Dans la combustion, les composés organiques sont complètement brûlés et se sont oxydés en CO2 et en eau. Le processus a besoin d'oxygène pour se produire. Cependant, en oxydation, l'oxygène est ajouté au composé. En cas d'oxydation de l'élément, nous pouvons dire qu'une ion de charge négative a été perdue ou un atome est perdu de l'élément.
Chaque fois que la combustion se déroule, l'oxydation est le résultat final, mais ce n'est pas la même chose pour l'oxydation. La combustion s'accompagne de réactions exothermiques qui se produisent après une série de réactions chimiques complexes. Il s'agit d'un oxydant nécessaire pour catapulter l'expérience. La chaleur et la lumière sont également produites pendant la réaction. D'un autre côté dans l'oxydation, l'oxygène est gagné et les molécules d'hydrogène ou les électrons sont perdus, donnant ainsi à l'élément ou au composé une forme oxydée.
Que se passe-t-il dans la combustion? Dans ce processus, le composé réagit avec l'élément qui agit comme un élément oxydant (par exemple l'oxygène ou le fluor). La substance finale obtenue se compose de composés qui ont également l'élément oxydant dans le cadre de leur chimie. Quelle est la procédure d'oxydation? En oxydation, l'état d'oxydation du composé est modifié par deux processus:
Processus redox: par exemple l'oxydation du carbone en CO2.
Réduire l'élément de carbone pour obtenir du CH4, également connu sous le nom de méthane à l'aide de l'hydrogène.
Cela peut également être représenté par l'exemple d'oxydation du sucre qui se déroule dans le corps humain. Ce processus implique une série de processus très complexes qui incluent les transferts d'électrons dans la structure cellulaire.
Il peut y avoir différents types de processus de combustion comme la combustion rapide, la combustion complète et la combustion incomplète. Nous pouvons définir l'oxydation comme un processus dans lequel l'oxygène réagit avec les substances qui viennent dans son contact et forment des substances qui ont des propriétés différentes. Par exemple, le fer ou le Fe est converti en Fe3O4 lorsque l'oxygène réagit avec lui. Ceci est également appelé rouille qui se produit dans notre vie quotidienne. L'oxydation peut également avoir lieu en cas d'organismes vivants.
La combustion se déroule dans les carburants liquides que vous brûlez dans vos véhicules. Ce processus se déroule dans une atmosphère où l'oxygène est disponible et toute la réaction se déroule en phase gazeuse.
Résumé:
1. Dans le processus de combustion, les composés organiques sont oxydés en carbone et en molécules H2O. Le processus nécessite la participation à l'oxygène. Alors qu'en oxydation, un ion est perdu par l'ajout d'oxygène.
2. En combustion, l'oxydation est le processus final, mais la même chose n'est pas vraie pour le processus d'oxydation.
3. Dans la chaleur et la lumière, la chaleur et la lumière sont produites mais ce n'est pas la même chose avec l'oxydation.

