Différence entre les périodes et les groupes
- 800
- 6
- Juliette Paul
Les périodes et les groupes sont les deux classifications importantes que les chimistes anciens ont utilisés pour organiser le tableau périodique emblématique en colonnes et rangées. Les périodes sont les lignes horizontales tandis que les groupes, également appelés familles, sont les colonnes verticales. Les éléments ont été organisés en groupes et périodes en fonction de certaines caractéristiques telles que les propriétés chimiques / physiques pour les groupes et les configurations d'électrons pour les périodes. L'article déploie d'autres différences entre les périodes et les groupes.

Quelles sont les périodes?
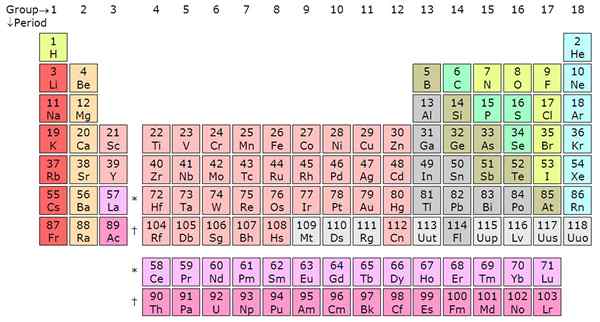
En comptant de gauche à l'extrême droite sur le tableau périodique, c'est la période. Il y a généralement 7 périodes dans un tableau périodique et chaque période indique une nouvelle coquille d'énergie. De l'hydrogène jusqu'au francium dans la période 7, les éléments augmentent des orbitales atomiques. Cela signifie que les électrons de l'élément seront représentés sur un nombre spécifique de niveaux d'énergie en ligne avec l'étiquette périodique.
Le lithium (LI), par exemple, a deux coquilles d'énergie car elle est dans la période 2 tandis que le potassium (k) a quatre coquilles d'énergie car elle est dans la période 4. Cette tendance est vraie pour tous les autres éléments. Dans une période, les éléments partagent les électrons de la coque externe (valence). Par exemple, l'hydrogène et l'hélium sont dans le même groupe et ont un électron dans la coque externe. Notez que la première période n'a que deux éléments. Les deuxième et troisième périodes ont 8 éléments chacun.
Les périodes 4 et 5 ont chacune 18 éléments. Le tableau périodique a, au total, 18 groupes selon le système de dénomination de l'IUPAC. Les périodes 6 et 7 sont les exceptions car elles contiennent 32 éléments au total. Cela explique pourquoi le tableau périodique est raccourci en supprimant une partie de la période 6 et 7 et en affichant juste en dessous du tableau périodique. Le périodique serait important si les actinides et les lanthanides n'étaient pas supprimés. Ces éléments séparés sont des métaux de transition intérieurs et ils remplissent le bloc F dans les orbitales atomiques. Les lanthanides incluent les éléments de 58 à 71 tandis que les actinides incluent les éléments de 89 à 103.
L'autre caractéristique que les éléments dans une période partagent est une augmentation de l'énergie d'ionisation. Les atomes dans une augmentation de la période du nombre atomique à mesure que de plus en plus de protons sont de plus en plus ajoutés. Cela augmente l'attraction dans le noyau et il deviendra relativement difficile de retirer un électron. L'augmentation de la charge nucléaire à travers le tableau périodique. De plus, l'électronégativité augmente lorsque vous vous déplacez de gauche à droite à travers la période. L'affinité des électrons augmente également à mesure que davantage d'électrons sont ajoutés, ce qui augmente ainsi une forte force d'attraction avec le noyau.
Que sont les groupes?
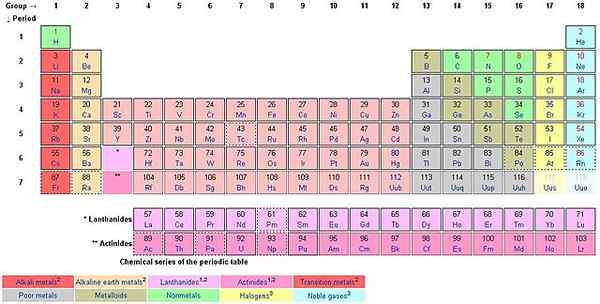
Lorsque vous comptez de haut en bas le long des colonnes, vous comptez les groupes. Le style de dénomination européen ꟷ désormais adopté comme style de dénomination de l'IUPAC, est utilisé pour nommer les groupes de 1 à 18. Le style américain utilise AS et BS.
Chacun des 18 groupes porte un nom. Par exemple, le premier groupe est connu sous le nom de famille du lithium (métaux alcalins), groupe 2 The Beryllium Family (Alcaline Earth Metals, groupe 3 The Scanium Family, groupe 4 The Titanium Family, Groupe 5 The Vanadium Family, Groupe 6 The Chromium Family , Groupe 7 The Manganese Family, Groupe 8 The Iron Family, Groupe 9 The Cobalt Family, Groupe 10 The Nickel Family, Groupe 11 The Copper Family (Coinage Metals), Groupe 12 La famille du zinc (métaux volatils), groupe 13 The Boron Family (icoasagens), la famille du carbone du groupe 14 (cristallogènes, tétrels), le groupe 15 La famille d'azote (Pentels), le groupe 16 La famille d'oxygène (chalcogènes), le groupe 17 La famille du fluor (halogènes) et le groupe 18 La famille d'hélium ou de néon (famille néon ( gaz nobles).
Les éléments d'un groupe partagent des propriétés chimiques ou physiques. Le groupe 18, par exemple, est appelé noble gaz. Ils ne sont pas réactifs avec d'autres éléments. La règle d'octet de 8 électrons dans la coque externe s'applique parfaitement aux gaz nobles. Tous les autres éléments s'efforcent d'atteindre la règle des octets. L'hydrogène ne suit pas la règle des octets, tout comme l'hélium bien qu'il soit stable et fait partie des gaz nobles.
Le tableau d'époque a un mélange de métaux, de non-métaux et de métalloïdes (demi-métaux). Il y a un certain regroupement d'éléments en fonction de leurs propriétés similaires et celles-ci incluent les métaux alcalins, les métaux de la terre alcaline, les métaux de transition (lanthanides, les métaux de terre rares et les actinides), les non-métaux, les métalloïdes, les gaz nobles, les halogènes et les métaux basiques.
Il y a aussi une tendance à l'augmentation des propriétés lorsque vous baissez ou augmentez le groupe. Au fur et à mesure que vous montez, la propriété Affinity 9electron Aimer) augmente. Lorsque vous descendez le groupe, les coquilles d'énergie augmentent et donc une attraction dans le noyau diminue, donc l'affinité électronique diminue à mesure que vous descendez. L'électronégatif diminue également lorsque vous descendez le groupe en raison d'une augmentation des niveaux d'énergie dans le groupe. Les électrons dans la coque externe ont tendance à être loin du noyau et donc la piscine diminue.
Différences clés entre les périodes et les groupes
Emplacement sur le tableau périodique
Les périodes sont des lignes horizontales tandis que les groupes sont les colonnes verticales du tableau périodique. Il y a 7 périodes et 18 groupes. Les période 6 et 7 ont 32 éléments en raison de l'ajout des actinides et des lanthanides.
Définition des caractéristiques
Les éléments d'un groupe partagent des propriétés chimiques ou physiques similaires. Ils ont le même nombre d'électrons de valence. D'un autre côté, les éléments de la même période partagent la même configuration d'électrons.
Électronégativité
L'électronégatif diminue lorsque vous descendez le groupe et augmente à mesure que vous augmentez en raison d'une traction accrue du noyau en raison de moins de niveaux d'énergie. L'électronégativité augmente au fur et à mesure que vous passez de gauche à droite à travers la période avec l'ajout de plus de protons à mesure que les nombres atomiques augmentent.
Périodes vs. Groupes: forme tabulaire

Résumé des périodes vs. Groupes
- Le tableau périodique est organisé en périodes et groupes
- Les groupes sont des colonnes verticales tandis que les périodes sont les rangées horizontales
- Les éléments d'un groupe partagent des propriétés chimiques ou physiques tandis que les éléments dans une période ont les mêmes configurations d'électrons
- Il y a 7 périodes et 18 groupes sur le tableau périodique
- L'électronégativité augmente de gauche à droite dans la période et du bas en haut dans le groupe

