Différence entre le phosphore et le phosphate
- 3341
- 115
- Théo Roy
Qu'est-ce que le phosphore?
Le phosphore (P) est un élément chimique non métallique multi-valent du groupe VA, n ° 15 du système périodique. Sa masse molaire est de 30.97. Vingt-trois isotopes de phosphore sont connus, mais un seul est stable.

Le phosphore est un élément hautement réactif. Il réagit avec l'oxygène, les halogènes, le soufre et de nombreux métaux. En raison de sa réactivité élevée, le phosphore ne peut pas être trouvé comme un élément libre sur Terre.
L'atome de phosphore contient cinq électrons de valence sur sa couche extérieure. Dans les composés avec des métaux et de l'hydrogène, le phosphore présente un degré d'oxydation de -3 et en interaction avec des éléments plus électronégatifs, comme l'oxygène, le fluor, etc., Les degrés d'oxydation sont +3 ou +5.
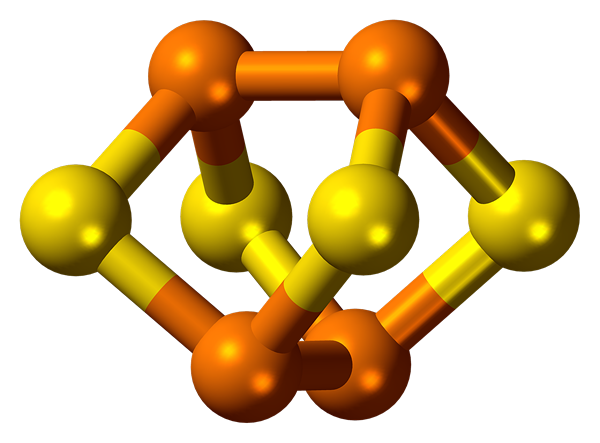
Le phosphore se caractérise par l'allotropie. Il forme plusieurs substances simples qui diffèrent en structure et en propriétés. Les plus largement distribués sont le phosphore blanc et rouge.
Le phosphore blanc se compose de p4 molécules. C'est une substance blanche comme une cire avec une teinte jaune qui brille dans l'obscurité. Le phosphore blanc n'est pas soluble dans l'eau mais est soluble dans le disulfure de carbone. C'est toxique. Il est très réactif et peut s'enflammer spontanément.
Le phosphore rouge a un réseau de cristal atomique. Il ne se dissout pas dans l'eau et le disulfure de carbone. Il n'est pas toxique et a une activité plus faible par rapport au phosphore blanc.
Les modifications allotropes du phosphore sont interconvertibles.
Qu'est-ce que le phosphate?
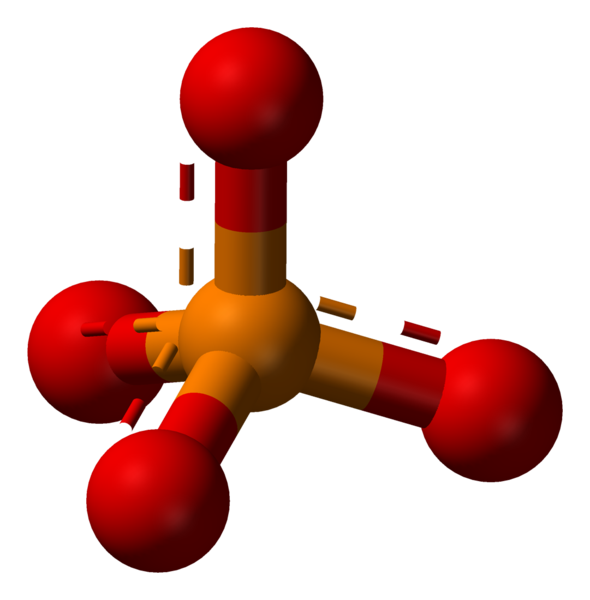
Le phosphate est une dérivée chimique de l'acide phosphorique, contenant l'ion phosphate (PO3-4). Le phosphate ion peut former une variété de sels différents. Formellement, tout sel d'un phosphore oxoacide est un phosphate.
L'ion phosphate est un ion polyatomique avec un arrangement tétraédrique des atomes. Il se compose d'un atome de phosphore, situé au centre et entouré de quatre atomes d'oxygène. La masse molaire de l'ion phosphate est 94.97 g / mol.
Selon le nombre d'atomes de phosphore, les phosphates peuvent être divisés en quatre grands groupes: orthophosphates, pyrophosphates, tripolyphosphates et polyphosphates. Chacun de ces groupes a ses propres propriétés fonctionnelles spécifiques.
Différence entre le phosphore et le phosphate
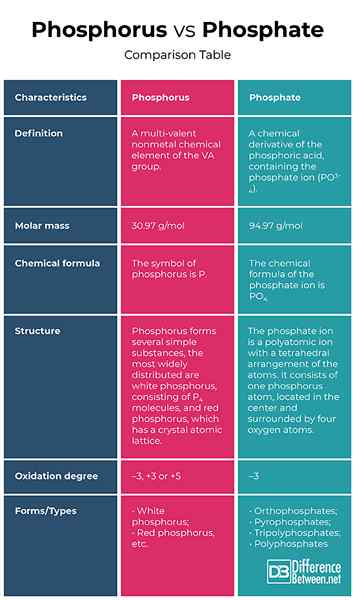
Définition
Phosphore: Le phosphore est un élément chimique non métal multi-valent du groupe VA.
Phosphate: Le phosphate est une dérivée chimique de l'acide phosphorique, contenant l'ion phosphate (PO3-4). Formellement, tout sel d'un phosphore oxoacide est un phosphate.
Masse molaire
Phosphore: La masse molaire du phosphore est de 30.97 g / mol.
Phosphate: La masse molaire de l'ion phosphate est 94.97 g / mol.
Formule chimique
Phosphore: Le symbole du phosphore est p.
Phosphate: La formule chimique de l'ion phosphate est Po4.
Structure
Phosphore: Le phosphore forme plusieurs substances simples, les plus largement distribuées sont le phosphore blanc, composé de p4 molécules et phosphore rouge, qui a un réseau atomique cristallin.
Phosphate: L'ion phosphate est un ion polyatomique avec un arrangement tétraédrique des atomes. Il se compose d'un atome de phosphore, situé au centre et entouré de quatre atomes d'oxygène.
Diplôme d'oxydation
Phosphore: Dans les composés avec des métaux et de l'hydrogène, le phosphore présente un degré d'oxydation de -3 et en interaction avec des éléments plus électronégatifs, comme l'oxygène, le fluor, etc., Le degré d'oxydation est +3 ou +5.
Phosphate: Le phosphate présente un degré d'oxydation de -3.
Formulaires / types
Phosphore: Le phosphore est caractérisé par l'allotropie et forme plusieurs substances simples qui diffèrent en structure et en propriétés. Les plus largement distribués sont le phosphore blanc et rouge.
Phosphate: Selon le nombre d'atomes de phosphore, les phosphates sont des orthophosphates, des pyrophosphates, des tripolyphosphates et des polyphosphates.
Phosphore vs. Phosphate: table de comparaison
Résumé du phosphore vs. Phosphate:
- Le phosphore est un élément chimique non métal multi-valent du groupe VA.
- Le phosphate est une dérivée chimique de l'acide phosphorique, contenant l'ion phosphate (PO3-4). Formellement, tout sel d'un phosphore oxoacide est un phosphate.
- La masse molaire du phosphore est de 30.97 g / mol. La masse molaire de l'ion phosphate est 94.97 g / mol.
- Le symbole du phosphore est p. La formule chimique de l'ion phosphate est Po4.
- Le phosphore blanc se compose de p4 molécules, le phosphore rouge a un réseau de cristal atomique. L'ion phosphate est un ion polyatomique avec un arrangement tétraédrique des atomes, composé d'un atome de phosphore, situé au centre et entouré de quatre atomes d'oxygène.
- Le phosphore présente un degré d'oxydation de -3, +3 ou +5. Le phosphate présente un degré d'oxydation de -3.
- Le phosphore forme plusieurs substances simples qui diffèrent en structure et en propriétés, les plus largement distribuées sont le phosphore blanc et rouge. Selon le nombre d'atomes de phosphore, les phosphates sont des orthophosphates, des pyrophosphates, des tripolyphosphates et des polyphosphates.

