Différence entre les réactifs et les produits
- 3553
- 33
- Juliette Lacroix

Réactions chimiques
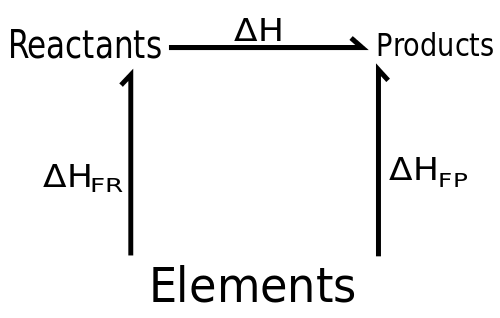
L'univers entier est composé de différents éléments chimiques. Ces éléments chimiques subissent une série de changements, et le processus par lequel ces substances chimiques se transforment en une autre substance chimique est appelée réaction chimique. Les réactions chimiques sont un aspect important de notre vie quotidienne. Par exemple, le processus de combustion de carburant nous permet de profiter du confort de conduire un véhicule. Ceci est rendu possible par des réactions chimiques qui produisent une énergie qui peut être utilisée par les voitures, les camions et les véhicules de transport. Dans l'industrie alimentaire, de nombreux produits alimentaires sont le résultat de réactions chimiques. Quelques exemples pour ces produits alimentaires et boissons sont la bière, le vin, le fromage et le yaourt. Une réaction chimique appelée fermentation est responsable de la création de ces substances. Les réactions chimiques sont également responsables des changements environnementaux. Le processus par lequel l'eau s'évapore et produit de la pluie est le résultat de ces réactions chimiques. Les catastrophes naturelles telles que les éruptions volcaniques, les glissements de terrain, les tremblements de terre et les typhons sont le résultat d'une série de réactions chimiques qui transforment un élément à un autre. Même le corps humain a des réactions chimiques au sein de ses systèmes d'organes qui nous permettent de survivre. Les déséquilibres à ces réactions peuvent entraîner des maladies humaines. Les réactions chimiques ont lieu en raison de substances chimiques regroupées en réactifs et produits. Cet article est écrit pour explorer les différences concernant ces deux substances.
Réactifs chimiques
Les réactifs chimiques sont des substances chimiques qui se combinent afin de former un autre composé. Par exemple, l'eau est composée d'éléments chimiques tels que l'hydrogène et l'oxygène. Un autre exemple est le sel, qui est composé d'une combinaison des éléments chimiques, du sodium et du chlorure. Ces éléments singuliers se combinent ou subissent une réaction chimique pour former de nouveaux composés chimiques. Mis à part les éléments chimiques, les réactifs peuvent également impliquer des substances plus complexes, comme les composés. Par exemple, le bicarbonate de soude est composé de plusieurs éléments, à savoir le sodium, l'hydrogène, le carbone et l'oxygène. Il est formé par une réaction chimique entre l'hydroxyde de sodium et le dioxyde de carbone. L'hydroxyde de sodium est une combinaison de sodium, d'hydrogène et d'oxygène. Le dioxyde de carbone est une combinaison de carbone et de deux molécules d'oxygène. Lorsque ces réactifs chimiques se combinent, il se traduit par la formation de bicarbonate de sodium, ou ce que l'on appelle communément le bicarbonate de soude. Les chimistes ont une façon distincte d'écrire ces réactions dans une équation chimique. Les équations chimiques sont écrites de telle manière qu'une flèche est dirigée vers le produit final de la réaction chimique. Ces équations impliquent également l'utilisation d'autres substances impliquées dans la réaction. Ce sont des catalyseurs, des enzymes, une température et d'autres facteurs qui peuvent affecter l'interaction des substances chimiques. Dans ces équations, les symboles chimiques des réactifs sont placés sur le côté gauche de la flèche.
Produits chimiques
Comme son nom l'indique, les produits chimiques sont des substances formées à partir de réactifs chimiques. Dans l'exemple mentionné dans la section précédente, le produit chimique est du bicarbonate de soude. Ceci est formé par des réactifs chimiques composés d'hydroxyde de sodium et de dioxyde de carbone. Un autre exemple de produit chimique est l'eau, qui est formée par une combinaison de molécules d'hydrogène et d'oxygène, comme mentionné dans la section précédente. Dans les réactions chimiques qui impliquent une combinaison de particules atomiques, le produit final est généralement plus complexe que les réactifs. Au contraire, les réactions chimiques qui impliquent une réduction des particules atomiques ont tendance à avoir des produits chimiques moins complexes. Ces réactions dissolvent généralement les liaisons chimiques dans les composés qui étaient initialement présents. Un bon exemple de ce processus est vu dans les processus enzymatiques. La catalase est une enzyme produite par certaines particules bactériennes. Cette enzyme est importante pour décomposer le peroxyde d'hydrogène en eau et en oxygène. C'est la raison pour laquelle des bulles se forment lorsque le peroxyde d'hydrogène est appliqué sur les plaies. L'enzyme catalase est présente dans les bactéries qui contaminent les lits de la blessure. Il en résulte la dégradation du peroxyde d'hydrogène en produits chimiques qui ont été mentionnés précédemment. Dans les équations chimiques, les produits chimiques sont généralement placés sur le côté droit de la flèche. Cependant, il existe des interactions chimiques plus complexes dans lesquelles les produits peuvent également se transformer en réactifs. Ces équations chimiques utilisent généralement deux flèches opposées, ce qui indique une réversibilité chimique.
Résumé
Les réactions chimiques sont une partie importante de la vie. C'est le mécanisme par lequel les éléments sont transformés en composés et d'autres particules plus complexes. Des réactions chimiques se produisent généralement entre des substances appelées réactifs chimiques. Ces réactifs chimiques subissent des changements qui se traduisent par la formation d'une nouvelle substance, appelée le produit. À la fin de la réaction chimique, les réactifs sont généralement consommés et sont transformés en une nouvelle substance. D'un autre côté, les produits sont des points finaux des réactions chimiques, et elles sont produites à la fin du processus. Dans une équation chimique, les réactifs sont généralement placés sur le côté droit de la flèche. En revanche, les produits chimiques sont placés sur le côté gauche de l'équation.

