Différence entre Sigma et Pi Bond
- 3285
- 495
- Adrien Jean
Qu'est-ce que Sigma Bond?
Les liaisons sigma sont des liaisons entre les atomes à l'intérieur des molécules formées le long de l'axe reliant les noyaux liés des atomes.
Liaisons moléculaires
Les molécules se forment lorsque les atomes échangent ou partagent des électrons par liaison chimique. Il existe essentiellement trois types de liaisons. Obligations ioniques, obligations métalliques et liaisons covalentes. Dans les liaisons ioniques, les atomes échangeront simplement un électron pour qu'un atome devienne positivement chargé et l'autre chargé négativement, les faisant attirer. Dans les liaisons métalliques, les électrons seront uniformément distribués à travers la molécule entière créant une mer d'électrons libres et délocalisés enveloppant des ions chargés positivement attirés par les électrons.
Dans les liaisons covalentes, les électrons sont partagés et la façon dont ils sont partagés se fait par les nuages de probabilité des électrons et les orbitales dans lesquelles ils sont situés, se chevauchant d'une manière qui est à peu près symétrique.
Orbitals et obligations Sigma
Les orbitales sont des régions autour des atomes associés à certains niveaux d'énergie. Les électrons en orbitales plus éloignés du noyau auront plus d'énergie que les électrons en orbitales plus proches du noyau. Lorsque les orbitales d'un atome se chevauchent avec les orbitales d'un autre atome, ils forment des orbitales moléculaires qui permettent des liaisons moléculaires qui, bien sûr, permettent des molécules.
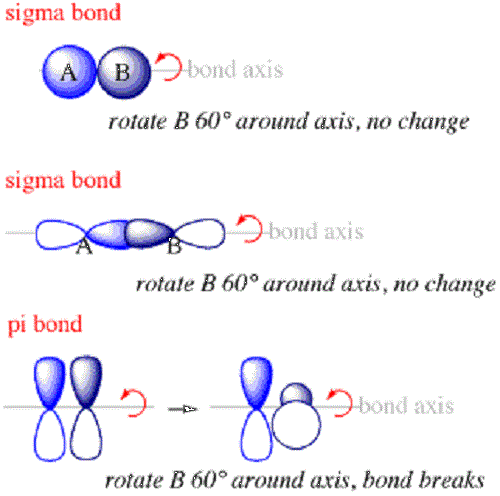
Les liaisons sigma sont le premier type de liaison qui se formera entre les atomes. Dans une liaison sigma, les nuages de probabilité électronique seront le long de l'axe reliant les noyaux des atomes liés. Les obligations Sigma se formeront généralement lorsque s Les orbitales de différents atomes se chevauchent pour créer un lien. Ils se formeront toujours le long de l'axe entre les deux noyaux parce que le s L'orbital est disposé en quelque chose comme une sphère autour du noyau.
Obligations Sigma et Orbitals Sigma
Les électrons constituant la liaison Sigma se trouvent dans les orbitales Sigma et se feront donc quelque part le long de l'axe reliant les noyaux des atomes liés. La liaison Sigma peut cependant être stable ou instable selon que les électrons sont dans une orbitale de liaison Sigma ou une orbitale anti-liaison.
Les orbitales de liaison sigma seront dans l'espace entre les noyaux tandis que les orbitales anti-liaison seront le long de l'axe reliant les noyaux mais sur les côtés des atomes opposés à l'espace entre eux. La liaison Sigma sera stable si plus d'électrons sont dans les orbitales de liaison et instables si d'autres sont dans les orbitales anti-aléatoires ou s'il y a un nombre égal d'électrons dans les deux.

Qu'est-ce que PI Bond?
Les liaisons Pi sont des liaisons entre les atomes à l'intérieur des molécules où les électrons sont au-dessus et en dessous de l'axe reliant les noyaux des atomes joints mais pas le long de l'axe. Ils sont le deuxième type de liaison qui se formera dans une molécule après la liaison Sigma.
Pi Bond et p orbitales
La raison pour laquelle les obligations Pi se forment au-dessus et au-dessous de l'axe de liaison mais pas le long de celle-ci parce qu'elles se forment généralement à partir d'orbitales qui se chevauchent tels que p orbitales sur les atomes liés. Ces orbitales n'ont pas de densité électronique au noyau. En conséquence, les électrons constituant les liaisons Pi qui se forment à partir du chevauchement p Les orbitales se regrouperont toujours dans une région qui n'est pas directement adjacente au noyau. Les obligations PI peuvent également se former entre d'autres orbitales atomiques, comme d orbitales qui ont des fonctionnalités en commun avec p orbitales.
Pi Obligations et orbitales PI
Quand p Des orbitales de différents atomes se chevauchent, ils créent des orbitales PI moléculaires qui permettent aux liaisons Pi de se former. La liaison peut à nouveau être stable ou instable en fonction de l'orbitale dans laquelle se trouve l'électron. La caution PI sera stable si plus d'électrons sont dans les orbitales de liaison PI. Il sera instable si plus se trouvent dans les orbitales anti-liaison ou si un nombre égal se trouve dans les deux.
Similitudes entre les obligations Sigma et les obligations PI
Les liaisons Sigma et les liaisons Pi sont toutes deux basées sur des orbitales moléculaires spécifiques qui sont dérivées du chevauchement d'orbitales atomiques particulières, par exemple, s orbitales dans le cas des obligations Sigma et p orbitales dans le cas des obligations PI. Ils peuvent également être stables ou instables selon que les électrons se trouvent dans les orbitales moléculaires de liaison ou les orbitales moléculaires anti-liaison.
Différences entre les obligations Sigma et les liaisons PI
Malgré leurs similitudes, il existe des différences importantes.
- Les électrons composant des liaisons Sigma seront distribués dans l'espace le long de l'axe reliant les noyaux joints tandis que les électrons à l'intérieur des liaisons Pi seront distribués au-dessus et au-dessous de l'axe mais pas le long de celui-ci.
- Les liaisons sigma sont les premières liaisons à se former entre les atomes dans les molécules tandis que les liaisons Pi sont la seconde.
- Les liaisons sigma sont souvent formées par la combinaison de s orbitales dans différents atomes tandis que les liaisons Pi sont formées à partir de la combinaison de p et des orbitales similaires dans différents atomes.
- De plus, l'orientation des orbitales qui se chevauchent qui forment des obligations PI seront perpendiculaires à celles des orbitales qui se chevauchent qui forment des obligations Sigma.
Sigma Bond vs. obligations PI
| Liaison sigma | Lien pi |
| Les orbitales atomiques se chevauchent le long de l'axe de liaison | Les orbitales atomiques se chevauchent au-dessus et au-dessous de l'axe de liaison |
| Premières liaisons à se former entre les atomes dans les molécules | Seconds liaisons à former entre les atomes dans les molécules |
| Formé à partir d'orbitales qui se chevauchent tels que s orbitales | Formé à partir d'orbitales qui se chevauchent tels que p orbitales |
| Orbitales qui se chevauchent perpendiculairement à ceux des obligations PI | Orbitales qui se chevauchent perpendiculairement à ceux des obligations Sigma |
Résumé: obligations Sigma et Pi
La liaison sigma est une liaison entre les atomes dans une molécule qui se forme souvent par s Orbitales se chevauchant le long de l'axe reliant les noyaux joints. C'est le premier à se former et sa stabilité dépend de la répartition des électrons dans la liaison Sigma et les orbitales antibondants. Les liaisons Pi sont des liaisons moléculaires formées souvent à partir de chevauchement p orbitales de différents atomes. Les électrons constituant des liaisons Pi seront distribués au-dessus et en dessous de l'axe reliant les noyaux des atomes liés mais pas le long de l'axe. La stabilité de ces obligations dépend également de la liaison et des orbitales PI. Les liaisons Sigma seront les premières liaisons à se former dans les molécules tandis que les liaisons Pi seront les deuxième liaisons à former. Les obligations Pi se forment également à partir d'orbitales atomiques orientés perpendiculaires à ceux qui composent les obligations Sigma.
- « Différence entre l'interdiction des voyages et l'état d'urgence
- Différence entre sous et en dessous »

