Différence entre l'acide fort et faible
- 1017
- 15
- Théo Roy
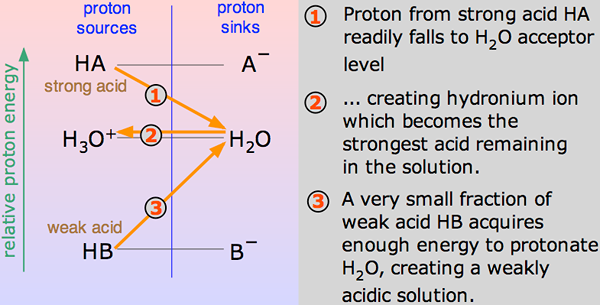
Les acides sont des substances chimiques qui donnent des ions hydrogène ou des protons lorsqu'ils sont mélangés dans des solutions. Le nombre de protons dégagé par un acide particulier détermine en fait la force de l'acide - qu'il s'agisse d'un acide fort ou d'un acide faible. Afin de comprendre la force des acides, il faut comparer leur tendance à donner des protons à la base similaire (principalement de l'eau). La force est indiquée par un nombre appelé PKA.

Qu'est-ce qu'un acide fort?
Un acide serait fort s'il se dissocie ou ionise complètement dans une solution. Cela signifie qu'il est capable de donner le plus grand nombre d'ions H + ou de protons lorsqu'il est mélangé dans une solution. Ces ions sont les particules chargées. Puisqu'un acide fort donne un plus grand nombre d'ions car il se décompose ou ionise, cela signifie qu'un acide fort est un conducteur d'électricité.
Lorsqu'un acide se mélange en H2O, un proton (h+ ion) est transporté à un h2O molécule pour générer un H3O+ (Ion hydroxonium) et un - ion basé sur lequel l'acide est impliqué pour commencer.
Dans un scénario général,
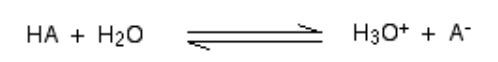
De telles réactions chimiques peuvent être vénérées, mais dans quelques cas, l'acide donne H+ ion assez facilement et la réaction ressemble à être à sens unique. Et l'acide est complet dissocié.
Pour e.g., Lorsque le chlorure d'hydrogène se dissout en h2O Pour faire du HCl, si peu de réaction inverse se produit que nous pouvons écrire:

À un moment donné, une réaction virtuelle à cent pour cent aura lieu dans laquelle le chlorure d'hydrogène montrera une réaction avec H3O+ (Ion hydroxonium) et Cl- ions. Ici, l'acide fort est le chlorure d'hydrogène.
Qu'est-ce qu'un acide faible?
Un acide serait faible s'il ionise partiellement ou incomplète, ne dégageant que certains de ses atomes d'hydrogène dans la solution. Par conséquent, il est moins capable par rapport à un acide fort pour dégager des protons. Les acides faibles ont une PKA plus élevée que les acides forts.
L'acide éthanoïque est un bon exemple d'acide faible. Il montre une réaction avec H2O pour produire H3O+ (Ions hydroxonium) et ch3COOH (ions éthanoate), mais la réaction inverse montre plus de succès que celle de l'avant. Les molécules réagissent assez facilement pour améliorer l'acide et le H2O.

À tout moment, seulement environ un pour cent du CH3Les molécules d'acide COOH montrent la conversion en ions. Tout ce qui reste est la simple molécules d'acide acétique (systématiquement appelé acide éthanoïque).
Différence entre l'acide fort et l'acide faible
-
Définition
Acide fort
Un acide fort est un acide qui ionise complètement dans une solution aqueuse. Un acide fort perdra toujours un proton (un h +) lorsqu'il est dissous en h2O. En d'autres termes, un acide fort est toujours sur ses orteils et assez efficace pour dégager des protons.
Acide faible
Un acide faible est celui qui ionise partiellement dans une solution. Il ne dégage que quelques-uns de ses atomes d'hydrogène dans la solution. Il est donc moins capable qu'un acide fort.
-
Conductivité électrique
Acide fort
Les acides forts montreront toujours une forte conductivité. Les acides puissants passent généralement plus de courant par rapport aux acides faibles pour la même tension et la même concentration.
Acide faible
Les acides faibles ont une faible conductivité. Ce sont de mauvais conducteurs et montrent une faible valeur pour le passage actuel
-
Vitesse de réaction
Acide fort
La vitesse de réaction est plus rapide dans les acides forts
Acide faible
Le taux de réaction est plus lent dans les acides faibles
-
Exemples
Acide fort
Acide chlorhydrique (HCl), acide nitrique (HNO3), Acide perchlorique (hclo4), Acide sulfurique (h2DONC4), Acide hydroiodique (HI), acide hydrobromique (HBR), acide chlorique (HCLO3).
Acide faible
Acide sulfureux (H2DONC3), Acide acétique (ch3COOH), acide phosphorique (h3Pote4), Acide benzoïque (c6H5COOH), acide hydrofluorique (HF), acide formique (HCOOH), acide nitreux (HNO2).
-
pH
Acide fort
Dans un acide fort, le pH est inférieur à, généralement 3. Les acides forts possèdent une concentration très élevée d'ions H + (un acide ayant un pH de 3 a 0.001 moles par litre d'ions hydrogène).
Acide faible
Un acide faible a un pH allant entre 3-7.
-
Valeur de PKA
Acide fort
Dans un acide fort, la valeur de PKA est assez faible.
Acide faible
Dans un acide faible, la valeur de la PKA est assez élevée.
-
Dissociation
Acide fort
Hcl (g) + h2o (l) ≈ h3O+(aq) + cl-(aq)
Acide faible
Ch3COOH (L) + H2O (L) ≈ H3O+(aq) + ch3ROUCOULER-(aq)
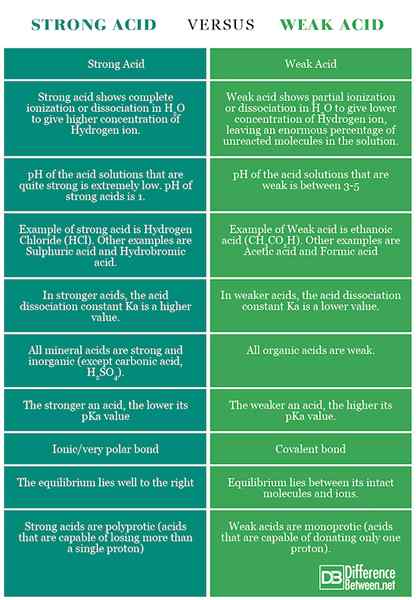
Résumé de l'acide fort vs. Acide faible
Les points de différence entre les acides forts et faibles ont été résumés ci-dessous: Tableau de comparaison
- « Différence entre la chaleur spécifique et la capacité de chaleur
- Différence entre les clubs de golf masculins et féminins »

