Différence entre l'état liquide et l'état gazeux
- 3842
- 1035
- Carla Lefevre
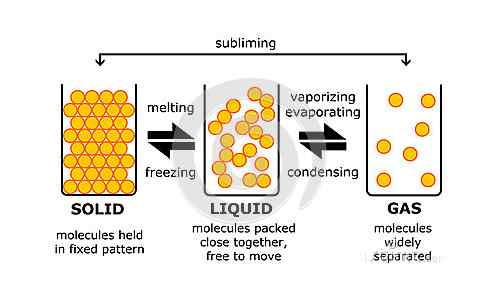
Tout ce qui existe physiquement et qui a la masse est défini comme la matière. Par exemple, votre bouteille d'eau est de la matière et il en va de même pour l'eau dedans. Cependant, la paresse que vous ressentez le matin ou que les pensées que vous avez dans votre esprit n'ont pas d'importance parce qu'elles n'existent ni physiquement et n'ont pas de masse. Maintenant que nous savons quelle est la matière, nous pouvons ajouter à cela en disant qu'il y a quatre États dans lesquels la matière existe. Ce sont des états plasmatiques, solides, liquides et gazeux. Les trois derniers sont les états de base de base ou conventionnels. Presque tout ce qui est classé comme la matière peut être converti en l'un de ces trois états tant que certaines conditions sont remplies. Ceux-ci peuvent inclure des changements de pression, de température, etc. Notez que bien que presque toute la matière puisse être convertie d'un état à l'autre, à température ambiante, il faut un état particulier. Par exemple, H2O est la formule chimique de l'eau qui existe à l'état liquide à température ambiante mais peut également devenir de la glace (état solide) ou de la vapeur (état gazeux).
La différence entre le liquide et les états gazeux est aux niveaux moléculaires, c'est-à-dire en raison de différentes caractéristiques des molécules dont ils sont composés de. Tout liquide est composé de minuscules particules qui vibrent à ou à proximité de leurs positions d'origine. Les particules sont maintenues ensemble par des forces intermoléculaires. Une masse donnée d'un liquide a un volume fixe, c'est-à-dire que la région est de rester fixe. Si vous versez un liquide dans un récipient, alors le liquide occupera une région égale à son volume. Ce n'est pas vrai pour la matière dans l'état gazeux. Les minuscules particules qui composent tous les gaz sont libres de se déplacer. Ils peuvent se déplacer n'importe où au hasard et les forces d'attraction entre ces particules sont très faibles. Ils sont moins que les forces dans un liquide et donc le mouvement d'un gaz est appelé mouvement aléatoire tandis que le mouvement d'un liquide est connu comme un mouvement fluide. De plus, le volume d'un gaz n'est pas fixé contrairement à un liquide. Étant donné que les particules sont dans un mouvement aléatoire, ils sont libres de se déplacer partout où ils peuvent. Par conséquent, le gaz prendra le volume du conteneur. Cela signifie que si un gaz est enfermé dans un conteneur, il aura le même volume que celui du conteneur. Les particules se propageront et occuperont autant de région que possible. Si la même quantité de gaz est ensuite déplacée vers un récipient plus grand, les particules de gaz occuperont alors un plus grand volume. Le volume a donc augmenté. Par conséquent, il est sûr de dire que le volume d'un gaz n'est pas fixe.
En raison des forces d'attraction plus faibles, les particules ont de grands espaces entre eux à l'état gazeux. Contrairement à cela, les particules dans un liquide ont un espace relativement inférieur entre eux. C'est également la raison du volume fixe d'un liquide par opposition à un gaz.
L'énergie des particules est un autre domaine où un gaz et un liquide sont différents. L'énergie des particules détermine également les espaces entre eux et donc l'état de la question. Les particules d'un gaz ont la plus grande énergie des trois états de base. Par conséquent, les particules montrent un grand mouvement et se propagent donc autant qu'ils peuvent. Les particules d'un liquide ont cependant une énergie plus faible que celles d'un gaz. Par conséquent, ils restent généralement à proximité de leurs positions initiales tant que les autres conditions restent les mêmes.
Résumé des différences exprimées dans les points
- Un liquide est composé de minuscules particules qui vibrent à ou à proximité de leurs positions d'origine; Un gaz est composé de particules qui sont libres de se déplacer partout où
- Le mouvement d'un gaz est aléatoire; Le mouvement d'un liquide est appelé flux
- Il existe des forces interoléculaires d'attraction plus fortes dans les liquides que les gaz
- Il y a un plus grand espacement entre les particules d'un gaz que celles d'un liquide
- Les particules d'un gaz ont une plus grande énergie que celles d'un liquide
- Les raisons mentionnées ci-dessus tiennent compte du volume fixe d'un liquide mais le volume d'un gaz n'est pas fixe et égal au volume du conteneur dans lequel il est


