Différence entre la base faible et la base forte
- 1742
- 488
- Sarah Poirier
Plusieurs définitions d'une base sont utilisées dans la chimie contemporaine:
- Base d'Arrhenius - une substance qui augmente la concentration d'anions d'hydroxyde lorsqu'il est dissous dans l'eau;
- La base de Brønsted-Lowry - une substance qui prend le proton lors de la réaction avec l'acide;
- Lewis Base - une substance qui donne une paire d'électrons d'une autre substance, lorsqu'il réagit avec l'acide.
Le plus largement utilisé est la définition de Brøndsted- Lowry.
Les bases au sens large comprennent trois groupes de substances:
- Hydroxydes métalliques solubles dans l'eau: Naoh, CA (OH)2, etc.;
- Oxydes ou hydroxydes insolubles dans l'eau qui peuvent réagir avec l'acide: Feo, Al (OH)3, etc.;
- D'autres composés qui, lorsqu'ils sont dissous dans l'eau, interagissent avec lui et libèrent des ions d'hydroxyde: NH3, Ch3NH2, etc.
Certaines des propriétés générales des bases sont:
- Savonneuse ou touche visqueuse;
- Goût amer;
- Conductivité électrique;
- Réaction violente avec des substances réductibles ou acides; caustique sur la matière organique;
- Tourner le papier ardent rouge bleu.
Qu'est-ce que la base faible?
Bases faibles uniquement se dissocier partiellement pour donner des ions en solution.
Lorsqu'une base ionise, elle laisse un OH- ion derrière en prenant un ion hydrogène de l'eau. Les solutions de bases faibles ont un H plus élevé+ concentration que celles de bases fortes.
La basicité d'une solution aqueuse est spécifiée par pH.
pH = -logdix [H+]]
Le pH des bases est supérieur à 7.3. Les faibles sont conditionnellement considérés comme les bases avec un pH inférieur à 10.
Puisque les bases sont des accepteurs de protons, la base reçoit un OH- ion de l'eau. Les bases faibles sont moins complètement protonées que les bases plus fortes et ont donc un H plus élevé+ concentration dans la solution. Plus haut H+ la concentration entraîne un pH inférieur.
En solution d'eau, les bases existent en équilibre chimique. La position de l'équilibre varie en fonction de la résistance de la base. Plus la base est faible, plus la gauche est déplacée l'équilibre.
La position de l'équilibre est mesurée par la constante d'équilibre (KB). Plus l'équilibre est à gauche, plus la valeur de la constante est faible. Ainsi, les bases les plus faibles ont des constantes d'équilibre inférieures.
Les bases faibles sont des électrolytes faibles.
La capacité d'une solution à conduire l'électricité dépend de la concentration d'ions. La solution d'une base faible a moins d'ions qu'une solution de forte, et il a donc une conductivité électrique inférieure.
Des exemples de bases faibles sont:
- Alanine (c3H5O2NH2));
- Éthylamine (c2H5NH2));
- Diméthylamine ((ch3)2NH);
- Méthylamine (ch3NH2));
- Glycine (c2H3O2NH2));
- Triméthylamine (ch3)3N);
- Hydrazine (n2H4).

Qu'est-ce que la base forte?
Des bases fortes se dissocient complètement pour donner des ions en solution. Ils ont un pH entre 10 et 14.
Les bases fortes sont caustiques pour les tissus vivants et peuvent avoir un impact grave. Les exemples courants de bases fortes sont les hydroxydes des métaux de la Terre alcalins et alcalins.
Des bases très fortes peuvent déprotone les groupes C-H acides faibles même en l'absence d'eau.
Les bases fortes ont une constante d'équilibre plus élevée, par rapport aux plus faibles.
Les bases fortes sont très réactives. Ce sont de bons électrolytes.
La capacité d'une solution à conduire l'électricité dépend de la concentration d'ions. Une base forte a plus d'ions dans la solution qu'un faible, il a donc une conductivité électrique plus élevée.
Des exemples de bases fortes sont:
- Hydroxyde de strontium (SR (OH)2));
- Hydroxyde de baryum (BA (OH)2));
- Hydroxyde de calcium (CA (OH)2));
- Hydroxyde de sodium (NaOH);
- Hydroxyde de césium (CSOH);
- Hydroxyde de potassium (KOH).
Différence entre la base faible et la base forte
-
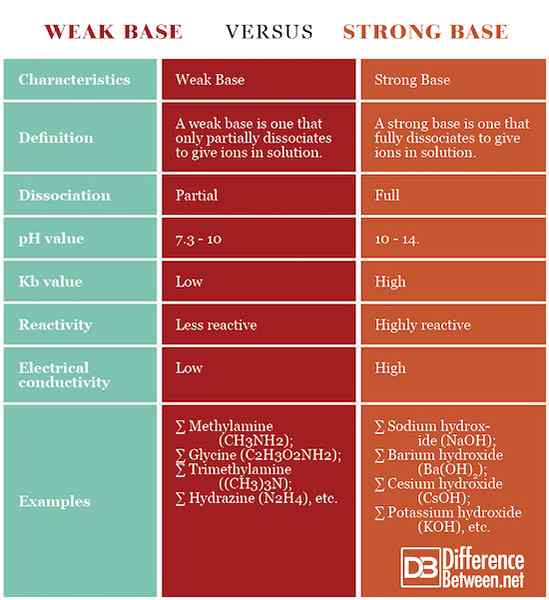
Définition
Base faible: Une base faible est celle qui se dissocie partiellement pour donner des ions en solution.
Base forte: Une base forte est celle qui se dissocie complètement pour donner des ions en solution.
-
Dissociation
Base faible: Bases faibles seulement partiellement se dissocier en solution.
Base forte: Des bases fortes se dissocient complètement en solution.
-
PH
Base faible: Les bases faibles ont pH 7.3 - 10.
Base forte: Les bases fortes ont un pH 10 - 14.
-
Valeur kb
Base faible: Les bases faibles ont des constantes d'équilibre inférieures, par rapport à celles fortes.
Base forte: Les bases fortes ont une constante d'équilibre plus élevée, par rapport aux faibles.
-
Réactivité
Base faible: Les bases faibles sont moins réactives que les fortes.
Base forte: Les bases fortes sont très réactives.
-
Conductivité électrique
Base faible: La solution d'une base faible a une conductivité électrique plus faible que celle d'une base forte.
Base forte: La solution d'une base forte a une conductivité électrique plus élevée que celle d'une base faible.
-
Exemples
Base faible: Des exemples de bases faibles sont la méthylamine (ch3NH2), glycine (c2H3O2NH2), triméthylamine ((ch3)3N), hydrazine (n2H4), etc.
Base forte: Des exemples de bases fortes sont l'hydroxyde de sodium (NaOH), l'hydroxyde de césium (CSOH), l'hydroxyde de potassium (KOH), l'hydroxyde de baryum (BA (OH)2), etc.
Faible vs. Base forte: tableau de comparaison
Résumé des faibles vs. Base forte
- Selon la définition de Brønsted-Lowry, une base est une substance qui occupe le proton lorsqu'il réagit avec l'acide.
- Les bases ont une touche savonneuse ou un toucher gluant et un goût amer. Ils réagissent violemment avec des substances réductibles ou acides et sont caustiques sur la matière organique.
- Une base faible est celle qui se dissocie partiellement pour donner des ions en solution.
- Une base forte est celle qui se dissocie complètement pour donner des ions en solution.
- Bases faibles ne se dissocient que partiellement dans une solution, tandis que les bases fortes se dissocient complètement dans une solution.
- Les bases faibles ont pH 7.3 - 10, les forts ont pH 10 - 14.
- Les bases faibles ont une constante d'équilibre inférieure, tandis que les bases fortes ont une constante d'équilibre plus élevée.
- Les bases fortes sont très réactives, tandis que les bases faibles sont moins réactives.
- La solution d'une base faible a une conductivité électrique plus faible que celle d'une base forte.
- Des exemples de bases faibles sont la méthylamine (ch3NH2), glycine (c2H3O2NH2), triméthylamine ((ch3)3N), hydrazine (n2H4), etc. Des exemples de bases fortes sont l'hydroxyde de sodium (NaOH), l'hydroxyde de baryum (BA (OH)2), hydroxyde de césium (CSOH), hydroxyde de potassium (KOH), etc.

