Différences entre les inhibiteurs des enzymes irréversibles et les inhibiteurs enzymatiques réversibles
- 1683
- 406
- Justine Dumas
Les inhibiteurs des enzymes sont de petites molécules et des ions capables de se lier aux enzymes afin de réduire leur activité catalytique. L'inhibition enzymatique est un mécanisme de contrôle important dans les systèmes biologiques. De plus, c'est le processus utilisé par de nombreux médicaments dans la réduction efficace de l'activité enzymatique médiée par la maladie. Les inhibiteurs de l'enzyme peuvent être classés comme irréversibles et réversibles.
Qu'est-ce que les inhibiteurs des enzymes irréversibles?
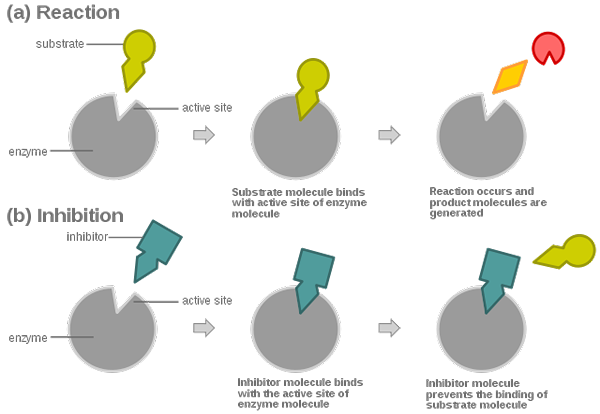
Les inhibiteurs irréversibles se lient étroitement à l'enzyme, en dissociant ainsi très lentement. Ils peuvent former des liaisons covalentes ou non covalentes avec leur cible.
De nombreux médicaments importants, comme la pénicilline, sont des inhibiteurs enzymatiques irréversibles. La pénicilline est un antibiotique capable de tuer des bactéries en se liant de manière covalente à l'enzyme transpeptidase, empêchant ainsi la synthèse de la paroi cellulaire bactérienne.
Un autre exemple est l'aspirine, qui forme des liaisons covalentes avec l'enzyme cyclooxygénase, entraînant la réduction des processus inflammatoires.
Les inhibiteurs irréversibles peuvent être classés en trois catégories: réactifs spécifiques au groupe, analogues de substrat et inhibiteurs du suicide.
Les réactifs spécifiques au groupe peuvent se lier à un résidu aminé particulier de l'enzyme et le modifier irréversiblement. Ils sont donc moins spécifiques, en mesure d'interagir avec de nombreuses enzymes.
Les analogues du substrat présentent une structure similaire au substrat de l'enzyme et peuvent modifier de manière covalente son résidu de site actif.
Les inhibiteurs du suicide sont les inhibiteurs de l'enzyme les plus spécifiques. Ils se lient sous forme de substrat à l'enzyme et sont traités par la réaction catalytique. La catalyse génère ensuite un intermédiaire qui inactive de manière covalente l'enzyme.

Qu'est-ce que les inhibiteurs de l'enzyme réversibles?
Les inhibiteurs réversibles forment des liaisons non covalentes avec l'enzyme. Ils se caractérisent par une dissociation rapide de leur cible.
Les inhibiteurs réversibles peuvent être classés en deux catégories principales, les inhibiteurs compétitifs et non compétitifs.
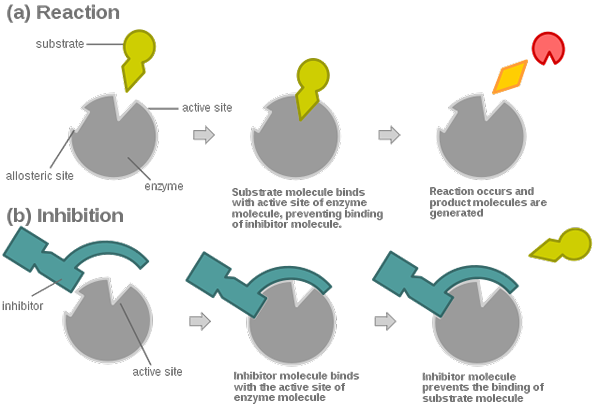
Un inhibiteur réversible est compétitif lorsque l'enzyme peut se lier à son site actif, soit à l'inhibiteur formant un complexe enzymatique-inhibiteur (EI), soit au substrat formant un complexe enzymatique-substrat (ES).
Dans ce cas d'inhibition concurrentielle, la liaison de l'enzyme au substrat ou à l'inhibiteur s'exclut mutuellement: l'enzyme ne peut jamais se lier à l'inhibiteur et au substrat en même temps.
La réduction de l'activité catalytique de l'enzyme est obtenue par la réduction de la proportion du complexe enzymatique-substrat.
L'augmentation de la concentration du substrat peut soulager l'inhibition de l'enzyme.
Dans l'inhibition non concurrentielle réversible, le substrat et l'inhibiteur se lient simultanément à différents sites de l'enzyme, le rendant inactif. Cette inhibition ne peut pas être surmontée en augmentant la concentration du substrat.
Différence et similitudes entre les inhibiteurs des enzymes irréversibles et réversibles
- Les inhibiteurs des enzymes irréversibles et les inhibiteurs enzymatiques réversibles sont capables de se lier aux enzymes et de réduire leur activité catalytique.
- Les inhibiteurs irréversibles se lient étroitement à l'enzyme cible, et la dissociation du complexe enzymatique-inhibiteur est très lente. L'effet d'inhibition est irréversible. Les inhibiteurs réversibles, de l'autre côté, se caractérisent par une dissociation rapide du complexe enzymatique-inhibiteur. L'effet d'inhibition est réversible.
- Les inhibiteurs irréversibles peuvent être classés en trois catégories: réactifs spécifiques au groupe, analogues de substrat et inhibiteurs du suicide. Les inhibiteurs réversibles sont classés en deux groupes: des inhibiteurs compétitifs et non compétitifs.
- Des analoges de substrat irréversibles et des inhibiteurs compétitifs réversibles agissent de la même manière en imitant le substrat spécifique à l'enzyme. Les analogues du substrat modifient irréversiblement le site actif de l'enzyme, tandis que l'inhibition concurrentielle peut être inversée en augmentant la concentration du substrat.
Inhibiteurs des enzymes irréversibles vs réversibles: table de comparaison

Résumé
Les inhibiteurs des enzymes irréversibles et réversibles sont des molécules capables de se lier aux enzymes et de les inactiver.
Alors que les inhibiteurs irréversibles agissent de manière plus permanente en modifiant les sites actifs et en se dissociant lentement de leur enzyme cible, les inhibiteurs réversibles sont caractérisés par une dissociation rapide de l'enzyme et leur activité d'inhibition peut être facilement inversée.

