Homogène vs. Mélanges hétérogènes

- 4225
- 537
- Sarah Poirier
Les mélanges sont différents des substances pures comme les éléments et les composés car les mélanges contiennent différentes substances qui sont combinées physiquement mais pas chimiquement. Les composants individuels d'un mélange conservent leur identité.
Les mélanges sont de deux types: homogène et hétérogène. Un mélange homogène a une composition et une apparence uniformes. Les substances individuelles qui constituent un mélange homogène ne peuvent pas être différenciées visuellement. D'un autre côté, un mélange hétérogène comprend deux substances ou plus qui peuvent être distinctement observées, et même séparées relativement facilement.
Tableau de comparaison
Différences - similitudes -| Hétérogène | Homogène | |
|---|---|---|
| Uniforme | Non | Oui |
| Vous pouvez voir les pièces | Oui | Non |
| Peut être séparé physiquement | Oui | Non |
| Exemples | Salade, mélange de sentiers | Huile d'olive, acier, sel dans l'eau |
| Lié chimiquement | Non | Non |
Caractéristiques physiques
Tous les mélanges comprennent deux ou plusieurs substances pures (éléments ou composés). La différence entre un mélange et un composé est de savoir comment les éléments ou les substances se combinent pour les former. Les composés sont des substances pures car elles ne contiennent qu'un seul type de molécule. Les molécules sont faites d'atomes qui se sont liés ensemble. Mais dans un mélange, des éléments et des composés se trouvent tous deux entremêlés physiquement mais non chimiquement-Aucune liaison atomique ne se forme entre les substances pures qui constituent le mélange.
Mais indépendamment des liaisons atomiques, les mélanges peuvent devenir assez cohésifs. Communément appelé solutions, Les mélanges homogènes sont ceux où les substances se mélangent si bien qu'elles ne peuvent pas être vues individuellement sous une forme différenciée et distincte. Leur composition est uniforme i.e., Idem tout au long du mélange. Cette uniformité est parce que les constituants d'un mélange homogène se produisent dans la même proportion dans chaque partie du mélange.
Inversement, un mélange hétérogène est celui où les substances constituantes ne sont pas uniformément distribuées. Ils peuvent souvent être racontés visuellement à part et même séparés relativement facilement, bien que de nombreuses méthodes existent également pour séparer les solutions homogènes.
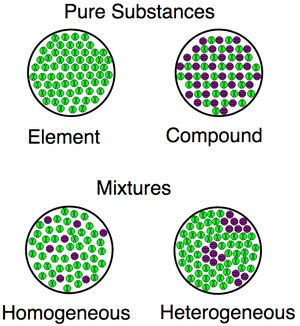 Une visualisation des différences entre les substances (composés, éléments) et les mélanges (homogènes et hétérogènes).
Une visualisation des différences entre les substances (composés, éléments) et les mélanges (homogènes et hétérogènes). Exemples de mélanges homogènes et hétérogènes
Des exemples de mélanges hétérogènes seraient des glaçons (avant qu'ils ne fondent) dans du soda, des céréales dans du lait, divers garnitures sur une pizza, des garnitures en yaourt glacé, une boîte de noix assorties. Même un mélange d'huile et d'eau est hétérogène car la densité de l'eau et de l'huile est différente, ce qui empêche la distribution uniforme dans le mélange.
Des exemples de mélanges homogènes sont les milkshakes, le jus de légumes mélangé, le sucre dissous dans le café, l'alcool dans l'eau et les alliages comme l'acier. Même l'air qui se trouve dans notre atmosphère est un mélange homogène de divers gaz et détendant sur la ville dans laquelle vous vivez des polluants. De nombreuses substances, comme le sel et le sucre, se dissolvent dans l'eau pour former des mélanges homogènes.
Types de mélanges
Il y a trois familles de mélanges: solutions, suspensions et colloïdes. Les solutions sont homogènes tandis que les suspensions et les colloïdes sont hétérogènes.
Solution
Solutions sont des mélanges homogènes qui contiennent un soluté dissous dans un solvant, e.g. sel dissous dans l'eau. Lorsque le solvant est de l'eau, il est appelé une solution aqueuse. Le rapport de la masse du soluté au solvant est appelé la concentration de la solution.
Les solutions peuvent être liquides, gazeux ou même solides. Non seulement cela, les composants individuels de la solution peuvent être différents états de matière. Le soluté suppose la phase (solide, liquide ou gazeux) du solvant lorsque le solvant est la plus grande fraction du mélange.
- Solutions gazeuses: lorsque le solvant est un gaz, il est seulement possible de dissoudre les solutés gazeux. L'exemple le plus courant d'une solution gazeux est l'air dans notre atmosphère, qui est l'azote (le solvant) et a des solutés comme l'oxygène et d'autres gaz.
- Solutions liquides: les solvants liquides sont capables de dissoudre tout type de solutés.
- Gaz dans le liquide: les exemples incluent l'oxygène dans l'eau ou le dioxyde de carbone dans l'eau.
- Liquide dans le liquide: L'exemple comprend des boissons alcoolisées; Ce sont des solutions d'éthanol dans l'eau.
- Solide dans le liquide: sucre ou salitions de sel dans l'eau sont des exemples de tels mélanges. Beaucoup de solides dans les mélanges liquides ne sont pas homogènes, donc ce ne sont pas des solutions. Ils pourraient être des colloïdes ou des suspensions.
- Solutions solides: les solvants solides peuvent également dissoudre les solutés de tout état de matière.
- Gas en solide: un exemple de ceci est l'hydrogène dissous dans le palladium
- Liquide en solide: des exemples de cela comprennent le mercure dans l'or, la formation d'un amalgame et l'eau (humidité) dans le sel
- Solide en solide: les alliages comme l'acier, le laiton ou le bronze sont un exemple de tels mélanges.
Suspension
Une suspension est un mélange hétérogène qui contient des particules solides qui sont suffisamment grandes pour la sédimentation. Les particules solides ne se dissolvent pas dans le solvant mais sont suspendues et flottantes librement. Ils sont plus grands que 1 micromètre et sont généralement suffisamment grands pour être visibles à l'œil nu. Un exemple est le sable dans l'eau. Une caractéristique clé des suspensions est que les particules en suspension se déposent dans le temps si elles sont restées non perturbées.
Colloïde
Les colloïdes sont hétérogènes comme les suspensions mais semblent visuellement homogènes parce que les particules du mélange sont très petites nanomètres à 1 micromètre. La différence entre les colloïdes et les suspensions est que les particules dans les colloïdes sont plus petites et que les particules ne se régleront pas avec le temps.
| Solution | Colloïde | Suspension | |
|---|---|---|---|
| Homogénéité | Homogène | Hétérogène au niveau microscopique mais visuellement homogène | Hétérogène |
| La taille des particules | < 1 nanometer (nm) | 1 nm - 1 micromètre (μm) | > 1 μm |
| Physiquement stable | Oui | Oui | A besoin d'agents stabilisants |
| Présentation de l'effet Tyndall | Non | Oui | Oui |
| Se sépare par centrifugeuse | Non | Oui | Oui |
| Séparés par décantation | Non | Non | Oui |
Technicité
Dans une certaine mesure, vous pourriez dire (si vous étiez pédant) que la question de savoir si un mélange est homogène ou hétérogène dépend de l'échelle à laquelle le mélange est échantillonné.
Si l'échelle d'échantillonnage est bien (petite), elle pourrait être aussi petite qu'une seule molécule. Dans ce cas, tout échantillon deviendrait hétérogène car il peut être clairement délimité à cette échelle. De même, si l'échantillon est tout le mélange, vous pouvez le considérer comme homogène.
Donc, pour rester pratique, nous utilisons cette règle d'or pour décider si un mélange est homogène: si la propriété d'intérêt du mélange est la même, quel que soit l'échantillon prélevé pour l'examen utilisé, le mélange est homogène.

